Thursday, December 31, 2009
Wednesday, November 08, 2006
Insuficiência Venosa Crônica
ARTIGO DE REVISÃOInsuficiência venosa crônica. Uma atualizaçãoChronic venous insufficiency. An updateLuís Henrique Gil França1, Viviane Tavares21. Cirurgião vascular, Santa Casa de Misericórdia de Curitiba. Pós-gradu-ando em Clínica Cirúrgica, Univ. Federal do Paraná, Curitiba, PR.2. Fisioterapeuta. Especialista em Traumato-ortopedia e Método Pilates.Artigo submetido em 23.06.03, aceito em 08.08.03.J Vasc Br 2003;2(4):318-28.Copyright © 2003 by Sociedade Brasileira de Angiologia e Cirurgia Vascular.318ResumoA insuficiência venosa crônica é uma doença extremamente rele-vante, que acomete pessoas de diferentes faixas etárias e que pode cau-sar sérios problemas socioeconômicos, como, por exemplo, ausência aotrabalho e até mesmo aposentadoria de indivíduos em fase produtivada vida. Essa doença tem elevadas incidência e prevalência, tendo asso-ciação com varizes, úlceras e lesões tróficas de membros inferiores. Odiagnóstico é clínico, e, quando necessário, são utilizados exames com-plementares. O tratamento envolve faixas ou meias elásticas, curativosespecíficos e procedimentos cirúrgicos. O objetivo deste artigo é fazeruma revisão atualizada sobre a avaliação e o tratamento da insuficiênciavenosa crônica.Palavras-chave: insuficiência venosa, úlcera venosa, diagnóstico.AbstractChronic venous insufficiency is an extremely relevant disease,attacking people of different ages, and it is associated with socio-economical problems like absence from work and even the earlyretirement of young people still in a productive phase of life. This diseasehas an elevated incidence and prevalence, including its association withvaricose veins, ulcers and trophic lesions. The diagnosis is clinical, andwhen necessary, additional tests are used such as photoplethysmography,duplex-scan and phlebogram. Treatment involves bandages or elasticstockings, specific dressings and surgical procedures. The purpose ofthis article is to create a current review of the evaluation and managementof chronic venous insufficiency.Key words: venous disease, chronic venous insufficiency, venousulcer.
A insuficiência venosa crônica (IVC) é uma doençacomum na prática clínica, e suas complicações, princi-palmente a úlcera de estase venosa, causam morbidadesignificativa. A ulceração afeta a produtividade notrabalho, gerando aposentadorias por invalidez, alémde restringir as atividades da vida diária e de lazer. Paramuitos pacientes, a doença venosa significa dor, perdade mobilidade funcional e piora da qualidade de vida.No Brasil, a importância socioeconômica da IVCpassou a ser considerada, pelo governo, somente nosúltimos anos, o que tem levado a um interesse crescentepelo conhecimento científico e clínico das questõesrelacionadas a essa doença1.Definição A insuficiência venosa crônica é definida como uma anormalidade do funcionamento do sistema venosocausada por uma incompetência valvular, associada ounão à obstrução do fluxo venoso. Pode afetar o sistemavenoso superficial, o sistema venoso profundo ou am-bos. Além disso, a disfunção venosa pode ser resultadode um distúrbio congênito ou pode ser adquirida2.EpidemiologiaA prevalência de insuficiência venosa crônica napopulação aumenta com a idade. Na Europa, em adul-tos entre 30 e 70 anos de idade, 5 a 15% apresentam essadoença, sendo que 1% apresenta úlcera varicosa. NosPage 2J Vasc Br 2003, Vol. 2, Nº4319Estados Unidos, em torno de 7 milhões de pessoas têmIVC, a qual é a causa de 70 a 90% de todas as úlceras demembro inferior3,4. Maffei et al.5, em estudo epide-miológico de alterações venosas de membros inferioresda população de Botucatu, SP, estimaram uma preva-lência de varizes de 35,5% e de formas graves de IVCcom úlcera aberta ou cicatriz de úlcera de 1,5%.Silva6, estudando as repercussões socioeconômicasda IVC, analisou o relatório publicado pelo Ministérioda Previdência Social, em 1984, sobre a incidência, emordem decrescente de freqüência, das 50 principaisdoenças que provocaram o afastamento temporário dotrabalho de segurados do sistema previdenciário estatalbrasileiro, bem como os benefícios pagos em conse-qüência. O ano de referência foi 1983. A IVC ocupavao 14º lugar. Apesar da alta incidência, o autor concluiuque esses números não refletiam inteiramente a realida-de brasileira, sendo necessários mais dados para umaconclusão real do problema e de seu custo para aeconomia da nação6.Estudando os fatores de risco, Scott et al.7de-monstraram que 50% dos pacientes tinham históriaprévia de trauma no membro inferior afetado (riscode 2,4% de desenvolvimento de IVC), e cerca de45% dos pacientes apresentavam história de trombo-flebite (risco de desenvolvimento de IVC de 25,7%).Uma história familiar de varizes ou IVC (sugerindoum componente genético) também estava associadaa um aumento na incidência.FisiopatologiaO sistema venoso é um sistema de capacitância,funcionando como reservatório sangüíneo, e que, nor-malmente, tem a função de carrear o sangue desoxige-nado de volta ao coração. As veias da panturrilha, emassociação com os tecidos circundantes, formam umaunidade funcional conhecida como bomba muscularou coração periférico, ativamente atuante na drenagemdo sangue venoso durante o exercício8.Classicamente, a IVC agrupa quatro formas clíni-cas: as varizes primárias ou essenciais, a síndrome pós-trombótica (SPT), as varizes por angiodisplasias congê-nitas (Síndrome de Klippel-Trenaunay, síndrome deParkes-Weber, síndrome de Bockenheimer) e as varizespor fístulas arteriovenosas adquiridas. Admite-se, hoje,que as varizes da gravidez constituem, também, umgrupo à parte, com características etiopatogênicas efisiopatológicas próprias1.Existem dois mecanismos para a hipertensão veno-sa. O primeiro é a pressão hidrostática, relacionado àpressão da coluna de sangue do átrio direito. Emsituações normais, o fluxo venoso corre, do sistemavenoso superficial para o profundo, através de veiascomunicantes com válvulas competentes, que impe-dem o retorno de sangue para as veias superficiais. Aincompetência das válvulas do sistema venoso profun-do e comunicante e o refluxo resultante causam hiper-tensão venosa8.A obstrução venosa, em pacientes que tiveramtrombose venosa profunda, tende à recanalização emum período de três a seis meses. Após esse processo,ocorre a lesão das cúspides das válvulas venosas peloprocesso trombótico e o conseqüente refluxo venoso.Com a presença do refluxo, no início do quadro, amusculatura da panturrilha tenta compensar a sobre-carga de volume das veias insuficientes, ejetando umvolume de sangue maior. Com o agravamento dorefluxo, a bomba torna-se insuficiente para promoveruma redução cíclica da pressão de 100 mmHg paraníveis de 0 a 30 mmHg. Instala-se, dessa forma, umquadro de hipertensão venosa crônica permanente,levando aos sinais e sintomas de IVC8.O segundo mecanismo é dinâmico e está relaciona-do à musculatura da panturrilha, que exerce papelimportante no retorno venoso. Essa bomba muscular,quando em perfeito funcionamento, comprime as veiasprofundas da panturrilha durante sua contração (osmaiores reservatórios desse sistema são os capilaressinusóides soleares e gastrocnêmicos). A válvula distalda veia profunda e as válvulas das veias perfurantesfecham-se, e o sangue é ejetado em direção ao coração.Durante o relaxamento da panturrilha, produz-se umaenorme queda de pressão nas veias profundas, podendoatingir pressões negativas; fecha-se, então, a válvulaproximal do eixo profundo. Dessa forma, a pressãovenosa da rede superficial torna-se mais elevada do quea dos eixos profundos, e o sangue é aspirado em profun-didade através das veias perfurantes. Assim, por meio deuma ação aspirante e compressora, reduz-se a pressãohidrostática venosa de um indivíduo, de 100 mmHg avalores de 0 a 30 mmHg, durante a deambulação. Abomba muscular, em um indivíduo sadio, ejeta o san-gue de modo tão eficaz que reduz a pressão intravascularvenosa a valores próximos de zero e é capaz de gerarpressões superiores a 200 mmHg. Para que essa bombamuscular funcione adequadamente, faz-se necessária apresença de veias de drenagem pérvias com válvulasInsuficiência venosa crônica – França LHG et aliiPage 3320J Vasc Br 2003, Vol. 2, Nº4competentes, musculatura eutônica e eutrófica, integri-dade neural e articulações livres. A disfunção da bombamuscular da panturrilha, associada ou não à disfunçãovalvular, também é responsável pela hipertensão veno-sa, levando a um acúmulo excessivo de líquido e defibrinogênio no tecido subcutâneo, resultando em ede-ma, lipodermatosclerose e, finalmente, ulceração8.A pressão venosa permanece elevada nos membrosinferiores durante a deambulação, quando, em condi-ções normais, deveria diminuir. Assim, os tecidos adja-centes são expostos a uma pressão venosa elevada con-tinuamente, enquanto o paciente permanece com aspernas para baixo. Ainda permanece sem explicação porque essa pressão elevada leva à formação de úlceras nosmembros inferiores. O edema secundário à hipertensãovenosa pode ser um dos fatores. Todavia, pacientes cominsuficiência cardíaca e/ou congestão hepática comedema de membros inferiores não desenvolvem as alte-rações de pele e úlceras características de pacientes cominsuficiência venosa crônica9.Duas teorias tentam explicar essas mudanças queocorrem em pacientes com IVC. A primeira argumentaque a pressão venosa elevada causa um aumento dotamanho do leito capilar e o alargamento dos porosintersticiais, permitindo um extravasamento de fibri-nogênio através dos poros, o qual se polimeriza emfibrina. O depósito de fibrina leva à formação demanguitos que interferem na difusão de oxigênio enutrientes, predispondo à formação de úlceras10,11.A segunda teoria afirma que os leucócitos seriamseqüestrados na parede endotelial no leito capilar ex-posto à pressão venosa elevada. Os leucócitos entrariamem contato com moléculas de adesão intracelulares naparede capilar. As células seriam ativadas, e ocorrerialiberação de citoquinas e radicais livres no leito venoso,o que levaria a uma reação inflamatória, com lesão dasválvulas venosas e do tecido adjacente, predispondo àulceração12,13.DiagnósticoO diagnóstico da insuficiência venosa crônica éeminentemente clínico, feito através da anamnese e doexame físico. Os itens a serem considerados na anamne-se são: a queixa e a duração dos sintomas, como, porexemplo, história da moléstia atual; caracterização dedoenças anteriores (especialmente a trombose venosa);traumatismos prévios dos membros; e existência dedoença varicosa. Os sintomas incluem sensação de pesoe dor em membros inferiores, principalmente no finaldo dia, e alguns pacientes referem prurido associado.No exame físico, devem ser observados os seguintessintomas: hiperpigmentação (a hemoglobina que per-manece no interior tissular transforma-se em hemossi-derina, que dá coloração castanha à pele), lipoderma-tosclerose (alteração devido à substituição progressivada pele e do tecido subcutâneo pela fibrose), edemadepressível (maior na perna sintomática), presença deveias varicosas, presença de nevos, aumento do compri-mento do membro e varizes de localização atípica. Oexame sempre deve ser realizado com boa iluminação,com o paciente em pé, após alguns minutos de ortosta-tismo14,15.A úlcera de estase venosa crônica inicia-se de formaespontânea ou traumática, tem tamanho e profundida-de variáveis, e curas e recidivas são freqüentes. Nasvarizes primárias, a úlcera dói somente quando infecta-da. Na seqüela de trombose venosa, a lesão geralmenteé mais dolorosa. As úlceras de estase geralmente apare-cem na face medial da perna, próximas ao maléolomedial. Possuem as seguintes características: bordosirregulares, rasas, com base vermelha e exsudato sero-hemático ou seropurulento e pigmentação ao redor.Estas geralmente não são dolorosas, a não ser que hajainfecção14,16.A avaliação da IVC apresenta um grau de comple-xidade maior do que a avaliação da doença arterial. Osdiferentes métodos diagnósticos da doença venosa de-pendem do examinador e requerem habilidade clínicaespecífica16.ClassificaçãoA primeira classificação da IVC foi proposta porWidmer17e tinha como desvantagens a natureza não-específica do estágio I e a ausência da diferenciaçãoentre as alterações tróficas no estágio II. A classificaçãoera a seguinte:• Classe I – edema, coroa flebectásica paraplantar.• Classe II – alterações tróficas (hiperpigmentação elipodermatosclerose).• Classe III – úlcera aberta ou cicatrizada.Após, surgiu a classificação de Porter:• Classe 0 – Assintomática.• Classe 1 – IVC leve. Edema moderado, dordiscreta e dilatação local ou generalizada de veiassubcutâneas.Insuficiência venosa crônica – França LHG et aliiPage 4J Vasc Br 2003, Vol. 2, Nº4321• Classe 2 – IVC moderada. Edema moderado asevero, varizes, dor em peso, hiperpigmentação elipodermatosclerose.• Classe 3 – IVC severa. Edema severo, varizes cali-brosas, anormalidades tróficas acentuadas e úlcera.Devido à necessidade de maior especificidade euniformidade na avaliação da doença venosa, foicriada a classificação CEAP (clinical signs; etiology;anatomic distribution; pathophysiology), que é utiliza-da atualmente2,18.Classificação clínica (C):• Classe 0 – Sem sinais visíveis ou palpáveis de doençavenosa.• Classe 1 – Telangiectasias e/ou veias reticulares.• Classe 2 – Veias varicosas.• Classe 3 – Edema.• Classe 4 – Alterações de pele (hiperpigmentação,lipodermatosclerose).• Classe 5 – Classe 4 com úlcera cicatrizada.• Classe 6 – Classe 4 com úlcera ativa.Classificação etiológica (E):• Congênita – EC.• Primária – EP.• Secundária – ES: pós-trombótica, pós-traumática eoutras.Classificação anatômica (A):• Veias superficiais – AS.• Veias profundas – AD.• Veias perfurantes – AP.Classificação fisiopatológica (P):• Refluxo – PR.• Obstrução – PO.• Refluxo e obstrução – PR,O.Diagnóstico diferencialO edema venoso e, ocasionalmente, o edema dainsuficiência cardíaca produzem hiperpigmentação emvirtude do fracionamento das hemácias extravasadas.Porém, somente o edema venoso progride para fibrosesubcutânea e atrofia cutânea em resposta às hemácias eproteínas plasmáticas extravasadas. O edema com for-mação de cacifo é produzido tipicamente pela insufici-ência cardíaca, mas também está presente quando oedema é produzido por hipoproteinemia severa17. Oedema devido à insuficiência cardíaca, assim como oedema venoso, pode ser aliviado pela elevação da extre-midade e desaparece durante a noite. Entretanto, noprimeiro caso, a mobilização do líquido pode produzirortopnéia, dispnéia paroxística noturna e nictúria. Oedema cardíaco e outros edemas ortostáticos tambémpodem evidenciar um certo grau de acometimento dospés, o que quase nunca ocorre com o edema venoso. Ainsuficiência cardíaca congestiva, com freqüência, cau-sa edema bilateral, em comparação com o edema venosoou linfedema. Porém, este também costuma ser assimé-trico, sendo comumente pior do lado esquerdo17. Olinfedema acomete tipicamente os artelhos, os pés, ostornozelos e as pernas de maneira ascendente. Noestágio tardio do linfedema, podem surgir áreas depigmentação. Porém, a pele fica hipertrófica, e ostecidos subcutâneos continuam cheios, pois acumula-se linfa com dimensões variáveis1,17. Os pacientes comlinfedema crônico apresentam-se, habitualmente, comtumefação indolor da extremidade. O edema não formacacifo ou é apenas parcialmente depressivo e acomete otornozelo e, na maioria dos pacientes, o pé. O edema dodorso do antepé assemelha-se à corcunda do búfalo,sendo característico em pacientes com linfedema. Osartelhos quadriculados também representam um aspec-to característico, sendo causados pelo alto conteúdoprotéico do líquido tecidual excessivo. Apesar de adermatite eczematosa crônica e a escoriação da peleocorrerem no linfedema de longa duração, como ocorrecom a hiperqueratose e a liquenificação (peau d‘órange),as ulcerações francas são raras1,17. O edema de longaduração, rico em proteínas, é freqüentemente sede deinfecção, principalmente por germes gram-positivos,em geral estreptococos beta-hemolíticos que penetramna pele por pequenas escoriações, ferimentos, picadasde inseto, etc., levando à infecção de pele e do tecidocelular subcutâneo (celulite) e da vasta rede linfáticasubcutânea (erisipela). Pode atingir grandes extensõesda perna, com dor intensa e hiperemia pelo processoinflamatório, sendo, em geral, acompanhado por sinto-mas gerais e febre alta. Essas crises de celulite e erisipelafreqüentemente levam à piora do quadro por aumentoda obstrução linfática1. As causas endócrinas de edemaInsuficiência venosa crônica – França LHG et aliiPage 5322J Vasc Br 2003, Vol. 2, Nº4também devem ser pesquisadas. O mais comum é oedema que aparece na insuficiência tiroidiana, caracte-rizando o mixedema. Além do edema, deve-se pesquisaroutras características do hipotireoidismo, como face delua cheia, pele seca, bradilalia, hipohidrose, pilificaçãoescassa e bradicardia17.O edema cíclico das mulheres está relacionado comfases pré e intramenstruais, cuja causa é um defeito naeliminação renal de sódio. O lipedema acomete o sexofeminino e corresponde à deposição anormal de gordu-ra nas duas pernas de modo simétrico17. Não há passa-do de erisipela e/ou celulite na anamnese. Não háespessamento da pele, ulcerações e alterações de hiper-pigmentação. Outras causas devem ser avaliadas, taiscomo edema gravitacional; edema idiopático; edemahipocalêmico; edema relacionado a medicamentos;edema devido à compressão extrínseca (cisto de Baker,hérnia inguinal, síndrome solear, veias gastrocnêmicas,estenose venosa, linfadenopatia, tumores de tecidosmoles e gravidez); e edema paraneoplásico17.Exames complementaresO Doppler de ondas contínuas é o principal méto-do de avaliação após o exame clínico, podendo detectarrefluxo em junção safeno-femoral ou safeno-poplítea.O eco-Doppler venoso determina a localização e amorfologia das alterações, principalmente do refluxoenvolvendo o território da veia safena magna e/ouparva; a localização das perfurantes incompetentes; oesclarecimento diagnóstico de edema sem outros sinaisde IVC; a avaliação de casos de varizes recidivadas eanomalias vasculares; a investigação de trombose veno-sa profunda prévia e de insuficiência valvular; e orefluxo em sistema venoso profundo15.A pressão venosa ambulatorial (PVA) refere-se àpressão medida em uma veia distal (habitualmente,uma veia do dorso do pé) após um exercício com osmúsculos da panturrilha. É definida como a pressãovenosa nas veias superficiais do pé no final de 10exercícios com as pontas digitais executados na posiçãoereta. Nos membros normais com válvulas competen-tes, a pressão venosa no pé é reduzida para 20 mmHg oumenos pelo exercício e, a seguir, retorna, lentamente,durante um período de 20 segundos ou mais, à medidaque as veias da panturrilha enchem-se novamente cominfluxo proveniente dos capilares. Foi estabelecido umalto grau de correlação entre os níveis cada vez maioresde pressão venosa ambulatorial e a incidência de ulcera-ção na perna em pacientes com IVC. A PVA está elevadana maioria dos pacientes com IVC originária dos siste-mas venosos, tanto superficial quanto profundo. Ospacientes com veias varicosas isoladas e veias comuni-cantes competentes apresentam uma ligeira elevação naPVA, enquanto os pacientes com incompetência valvu-lar profunda, incluindo a veia poplítea e as perfurantes,costumam ter níveis maiores de PVA. A presença deobstrução venosa profunda proximal concomitante podeelevar ainda mais os níveis de PVA. A pressão venosaambulatorial reflete os efeitos globais da incompetênciavalvular, da obstrução do fluxo venoso anterógrado e dafalência dos músculos da panturrilha. Entretanto, amedida da PVA não consegue separar o efeito individu-al de cada componente que contribui para a presença deIVC, e continua dentro de seus limites normais em umnúmero significativo de pacientes que desenvolvemulcerações cutâneas por estase venosa19.A pletismografia venosa pode ser utilizada na avali-ação do grau de acometimento da função venosa (obs-trução e refluxo), estimando a proporção de compro-metimento dos sistemas venosos superficial e profundoe, dessa forma, prevendo os resultados de cirurgia dosistema venoso superficial nos casos que apresentamcomprometimento tanto superficial quanto profundo.Deve ser considerada como teste quantitativo comple-mentar15.A pletismografia a ar (PGA) é um método não-invasivo, que quantifica a variação de volume da pernacomo resultado do enchimento ou esvaziamento dasveias devido à mudança de postura ou exercício. Como pletismógrafo a ar, utiliza-se um manguito que envol-ve toda a extensão da perna. O exame é interpretado emum gráfico que registra volume e tempo. Atualmente, ahemodinâmica da bomba muscular da panturrilha temsido estudada através da PGA pelos parâmetros defração de ejeção (FE) e fração de volume residual (FVR).Na pletismografia a ar, o parâmetro de maior signifi-cância é o índice de enchimento venoso, que também éutilizado para avaliar o resultado do tratamento cirúr-gico20. A incidência de ulceração está relacionada comFE e com o índice de enchimento venoso (IEV). FE <40%> 20 s), leve(15 a 20 s), moderado (5 a 15 s) e severo (> 5 s)2,14.A flebografia é indicada quando os métodos não-invasivos não forem decisivos para esclarecimento diag-nóstico e/ou orientação de tratamento nas angiodispla-sias venosas e na possibilidade de cirurgia do sistemavenoso profundo. A flebografia ascendente define aobstrução com precisão, enquanto a flebografia descen-dente identifica áreas de incompetência valvular. Aarteriografia é indicada nos casos de suspeita de fístulasarteriovenosas8,15.Na impossibilidade de realizar exames confirmató-rios, o diagnóstico clínico é suficiente para o início dotratamento clínico.TratamentoOs sintomas isolados que necessitam tratamentoapresentam melhora clínica com o uso de medicamen-tos vasoativos e/ou compressão elástica. Os diversostipos de medicamentos vasoativos possuem diversosefeitos nos variados sintomas. A diosmina, o dobesilatode cálcio, a rutina, os rutosídeos e o extrato de castanha-da-índia proporcionam reduções objetivas nos índicesde edema, podendo ser utilizados como terapêuticacomplementar22. Essas drogas não devem substituir otratamento de compressão elástica, nem os hábitos devida que melhorem a estase venosa, nem a terapêuticacirúrgica, quando corretamente indicada15.Vários estudos têm demonstrado a utilização efeti-va das drogas vasoativas como tratamento coadjuvanteda IVC. Pittler & Ernst demonstraram melhora clínicados sintomas de IVC em pacientes que usaram umproduto natural chamado Escin (horse-chestnut ex-tract)23. Laurent et al.24realizaram estudo duplo-cegoprospectivo em 200 pacientes para avaliar a eficácia dadiosmina micronizada. A melhora dos sintomas rela-cionados à IVC foi estatisticamente significativa. Wid-mer25demonstrou melhora significativa do edema edos sintomas relacionados à IVC nos pacientes quereceberam dobesilato de cálcio em comparação com ogrupo controle.Os diuréticos são raramente indicados. Essas dro-gas causam uma rápida mobilização do líquido inters-ticial, diminuindo o edema. Entretanto, esse efeitosomente acontece nos casos em que a drenagem nãotenha influência sobre a causa do edema. Essas drogascausam hemoconcentração e conseqüente hipercoagu-labilidade, sendo contra-indicadas nos casos de síndro-me pós-trombótica ou linfedema17.Em pacientes com eczema de membros inferioresque causam intensa reação alérgica, o uso de corticoste-róides tópicos está indicado1,26.Nas telangiectasias e veias reticulares, o trata-mento de escolha é a escleroterapia, com a opção detratamento cirúrgico por mini-incisões para retiradade veias reticulares. Sua indicação é principalmenteestética, devendo ser avaliada a perspectiva de melho-ra em relação aos riscos associados ao procedimento.O uso dos diferentes tipos de laser tem sido proposto,necessitando, entretanto, de maiores estudos de-monstrando sua real eficácia. O uso de medicamen-tos vasoativos e/ou de meias elásticas de compressãograduada é indicado na presença de sintomas associ-ados15.A cirurgia está indicada na presença de refluxo emjunção safeno-femoral ou safeno-poplítea e quando ficaclaramente demonstrado que esses troncos não repre-sentam via de maior importância no esvaziamentovenoso. Meias medicinais de compressão acima de 40mmHg, compatíveis com os diâmetros e com a forma-ção anatômica da perna, e bandagens inelásticas sãoeficazes no pós-operatório e podem proporcionar ummenor número de recidivas15,26.Em pacientes com edema associado a varizes(CEAP3), as meias elásticas de compressão graduadaacima de 35 mmHg são efetivas. As bandagens elásticase inelásticas também podem ser usadas desde que cor-retamente colocadas15.Compressão elásticaA compressão elástica atua através da diminuiçãono diâmetro do vaso, aproximando os folhetos dasválvulas, suprimindo ou atenuando o refluxo, dimi-nuindo a pressão venosa, aumentando a velocidadedo fluxo venoso (resultando em descongestão dostecidos e aspiração do sangue do leito capilar) e afunção da bomba venosa. A terapia elástica resultaem uma regressão parcial das alterações da paredevenosa. O aumento da atividade fibrinolítica é discu-tível17.Os tipos de compressão elástica são divididos emquatro classes, de acordo com a classificação européia eamericana (Tabela 1)17.Insuficiência venosa crônica – França LHG et aliiPage 7324J Vasc Br 2003, Vol. 2, Nº4As meias até o joelho são suficientes para o trata-mento. A meia elástica, localizada acima do joelho,pode atrapalhar a flexão dessa articulação8,26. Alémdisso, alguns pacientes não toleram as meias que co-brem todo o membro inferior. As contra-indicações aouso de meia elástica são as seguintes: presença de doençaarterial obstrutiva crônica de membros inferiores, insu-ficiência cardíaca descompensada e presença de abces-sos, dermatite exsudativa, úlcera de membros inferiorese alergia a algum componente da meia17.Na presença de alterações tróficas, o uso de meiaselásticas de compressão acima de 35 mmHg pode serbenéfico. As bandagens corretamente colocadas tam-bém atuam favoravelmente15.Tratamento cirúrgicoNão existem, ainda, evidências suficientes quedemonstrem o valor do tratamento cirúrgico. Noentanto, a correção da insuficiência venosa superfici-al, com a melhora funcional subseqüente, pode pro-mover melhora das alterações tróficas. A correçãocirúrgica do refluxo em junção safeno-femoral ousafeno-poplítea pode ser benéfica, aliviando a sobre-carga do sistema venoso profundo. A observação deque a correção do refluxo superficial freqüentementeresultava na correção do refluxo profundo sugere queo refluxo profundo, em pacientes com insuficiênciavenosa superficial primária, pode ser devido ao reflu-xo superficial. Os pacientes com edema e passado detrombose venosa profunda devem ser avaliados commaior rigor antes de serem submetidos ao tratamentocirúrgico27.Em pacientes com úlcera cicatrizada, a compres-são acima de 35 mmHg parece ser efetiva na preven-ção da recorrência da úlcera varicosa. Pacientes por-tadores de insuficiência venosa superficial apresen-tando úlcera cicatrizada devem ser submetidos atratamento cirúrgico.Os pacientes que apresentam insuficiência isola-da de veias perfurantes ligadas à úlcera devem sersubmetidos à ligadura ou interrupção das veias per-furantes. A presença de perfurantes incompetentesem pacientes com IVC avançada (CEAP 4-6) e comresposta inadequada à terapia clínica constitui indi-cação para a interrupção das veias perfurantes26. Éimportante a identificação dos mecanismos envolvi-dos no aparecimento da incompetência de veiasperfurantes, sejam estes incidentais, causadores ouvias colaterais de drenagem. Existem quatro tipos deveias perfurantes incompetentes: perfurantes respon-sáveis pelo refluxo, levando ao desenvolvimento devarizes primárias do sistema venoso superficial; veiasperfurantes que atuam como mecanismo compensa-dor através de colaterais para uma obstrução venosa;veias perfurantes alargadas, devido à incompetênciado sistema venoso superficial; e veias perfurantesafetadas por deficiência valvular congênita associadaao defeito da bomba muscular periférica28.Insuficiência venosa crônica – França LHG et aliiClassificaçãoIndicaçãoClasse I(leve compressão - 18-25 mmHg/15-21 mmHg)Prevenção de trombose venosa profunda e pequenas veiasvaricosas com sintomatologia leveClasse II(média compressão - 26-34 mmHg/23-32 mmHg)IVC moderada, após tratamento cirúrgico de varizes,tromboflebites, úlcera varicosa e prevenção de trombosevenosa profunda em pacientes de alto riscoClasse III(alta compressão - 37-49 mmHg/34-46 mmHg)IVC avançada com edema reversívelClasse IV(muito alta compressão - > 50 mmHg/> 49 mmHg)Linfedema e IVC muito avançado com edema irreversívelTabela 1 - Classificação de compressão elásticaPage 8J Vasc Br 2003, Vol. 2, Nº4325Cockett29, em 1988, estudou as indicações para aligadura das veias perfurantes. Esse autor dividiu ospacientes em três grupos. O primeiro era formado porpacientes com insuficiência do sistema venoso superfi-cial, com ou sem perfurantes incompetentes e semtrombose venosa profunda prévia. Esses pacientes be-neficiaram-se da retirada das veias insuficientes e daligadura das perfurantes quando necessário. O segundogrupo era formado por pacientes com história prévia detrombose venosa profunda das veias da panturrilha,que, na época, apresentam-se com incompetência dasveias perfurantes e sem evidência de obstrução ourefluxo do sistema venoso profundo. Esses pacientesbeneficiaram-se da ligadura das veias perfurantes in-competentes. O terceiro grupo era composto por paci-entes com obstrução ou refluxo severo do sistemavenoso profundo, e, nestes, a cirurgia de ligadura dasveias perfurantes foi controversa28,29.A ligadura subfascial das veias perfurantes incom-petentes foi, inicialmente, proposta por Linton paratratamento das úlceras venosas de membros inferio-res30. Uma incisão cirúrgica era realizada na face medialda perna, permitindo um acesso às veias perfurantes,incluindo as localizadas abaixo da fáscia do comparti-mento posterior profundo. Essa cirurgia possui algu-mas desvantagens, tais como as complicações da feridaoperatória e a necessidade de um tempo de internamen-to maior. Algumas variações dessa técnica foram desen-volvidas para diminuir as complicações pós-operatóri-as, entre elas o uso de pequenas incisões transversas oulongitudinais ou a divulsão às cegas das veias perfuran-tes no espaço subfascial31.Edwards, em 1976, descreveu o uso de um flebóto-mo introduzido por via subfascial, através de umaincisão feita imediatamente abaixo do joelho, passado,a seguir, até o nível do maléolo medial para romper asperfurantes. Essa técnica minimizava a incisão, que erafeita em um local afastado da doença. Porém, a aborda-gem era realizada às cegas31.Em 1985, na Alemanha, Hauer relatou uma técnicaendoscópica para visualizar e dividir as veias perfurantesincompetentes. Com sua contribuição, emergiu a cirur-gia endoscópica subfascial das perfurantes (CESP)32. Atécnica endoscópica de interrupção das perfurantesapresenta um número muito menor de complicaçõesdas feridas do que a técnica aberta e constitui o métodopreferido para ablação das perfurantes mediais. Esseprocedimento, aliado com a ablação do refluxo super-ficial, se presente, reduz, de maneira efetiva e durável, ossintomas da IVC e induz à cicatrização rápida dasúlceras. A recidiva das úlceras após correção das perfu-rantes e do refluxo superficial, nos pacientes com sín-drome pós-trombótica, é muito mais alta do que nospacientes com incompetência valvular primária. Apesardos resultados promissores, é necessário um estudoprospectivo randomizado para definir os benefícios, alongo prazo, da interrupção das perfurantes incompe-tentes em todos os pacientes com doença avançada epara determinar quais pacientes com a síndrome pós-trombótica devem ser submetidos a uma interrupçãodas perfurantes32.Uma úlcera aberta limpa em fase de granulação nãoconstitui uma contra-indicação para a CESP. As con-tra-indicações à CESP incluem doença oclusiva arterialcrônica associada, úlcera infectada, obesidade mórbidae pacientes de alto risco ou que não conseguem deam-bular. Diabetes, insuficiência renal ou úlceras em paci-entes com artrite reumatóide ou esclerodermia sãocontra-indicações relativas. Os pacientes com interrup-ção prévia das perfurantes ou aqueles com extensasalterações cutâneas, grandes úlceras circulares ou pernasvolumosas podem não ser apropriados para o procedi-mento. Aqueles com ulcerações laterais devem ser trata-dos, se apropriado, por interrupção aberta das perfu-rantes laterais ou posteriores32.O tratamento cirúrgico do sistema venoso pro-fundo é reservado para os pacientes portadores dedoença grave, casos em que o tratamento conserva-dor é ineficiente. Os pacientes candidatos ao trata-mento cirúrgico geralmente apresentam o quadro declaudicação venosa (durante a deambulação, devidoao aumento da pressão venosa, o paciente refere dorno membro afetado, que diminui lentamente apósrepouso prolongado)33. A restauração da patência éuma indicação cirúrgica rara, e a presença de obstru-ção da veia ilíaca, através de exames de imagem, nãoconstitui uma indicação única para o tratamentocirúrgico. Na ausência de claudicação, é importanteque sejam realizados estudos fisiológicos para confir-mar se a obstrução é hemodinamicamente significa-tiva, porque, quando as veias colaterais estão bemdesenvolvidas, a compensação é suficiente. Esse pas-so estabelece não somente a necessidade de umacirurgia, mas também a probabilidade de êxito tera-pêutico34.Dentre as opções cirúrgicas para casos de obstruçãoda veia ilíaca, citam-se as derivações fêmoro-femoraiscruzadas com veia safena contralateral (cirurgia deInsuficiência venosa crônica – França LHG et aliiPage 9326J Vasc Br 2003, Vol. 2, Nº4Palma-Dale) ou fêmoro-ilíacas diretas com prótesesaneladas de politetrafluoretileno (PTFE)34.Inicialmente descrita por Palma, no Uruguai, epopularizada por Dale, nos Estados Unidos, a pontevenosa cruzada suprapúbica com safena é uma técnicade reconstrução venosa útil para pacientes com obstru-ção proximal. Essa cirurgia requer um sistema venosoíleo-femoral contralateral normal para garantir a drena-gem venosa. Os resultados serão melhores quando omembro afetado não possuir obstrução infra-inguinalou incompetência do sistema venoso profundo. Essacirurgia é especialmente indicada em mulheres jovenscom oclusão crônica da veia ilíaca seguida de trombosevenosa ílio-femoral esquerda devido à síndrome deCockett-May-Thurner. Os resultados de melhora clíni-ca variam entre 63% e 89%. A perviedade varia entre70% e 85%. Husni et al. referem resultados melhorescom o uso de uma fístula arteriovenosa distal temporá-ria35. As técnicas de cirurgia endovascular através douso de trombolíticos, angioplastia e colocação de stenttêm sido utilizadas recentemente e com bons resultadosa curto prazo36. A derivação fêmoro-poplítea com veiasafena in situé utilizada para obstruções da veia femoralsuperficial34.Uma vez que a obstrução ao fluxo de saída pode sertratada pela recanalização do segmento venoso obstru-ído ou por derivação venosa, a incompetência valvularrequer a criação de uma ou mais válvulas funcionaispara evitar o refluxo. A restauração da competênciavalvular deve ser planejada conforme a etiologia dadoença. Na doença valvular primária, com anatomiapreservada e refluxo hemodinamicamente significativo(pelo menos grau dois na classificação de Kistner),existe indicação de valvuloplastia. A etiologia precisadesse distúrbio é desconhecida. Porém, se as cúspidesvalvulares são redundantes, resultam em coaptaçãoprecária e refluxo. A técnica de valvuloplastia de Kistnerutiliza a exposição direta das cúspides valvulares redun-dantes e refluentes para a colocação de suturas na basedas cúspides, que apertam as bordas livres da válvula ea tornam competente33. Os resultados são satisfatórioscom 63% de sucesso de tratamento da úlcera emseguimento de sete anos37.Nos casos de lesão valvular, como na síndrome pós-trombótica, por exemplo, são preconizados os trans-plantes ou transposições valvulares. Na seleção dospacientes, é importante que seja estabelecido se o reflu-xo está presente nas veias axiais e que não envolve ascolaterais. Nessa circunstância, a interposição de umaúnica válvula competente pode aliviar os sintomas. Umprocedimento muito utilizado é a transposição da veiaaxilar. O eco-Doppler deve ser utilizado para identificarum segmento venoso axilar de tamanho apropriado quecontenha um segmento valvar competente. A veia basí-lica torna-se veia axilar quando cruza a borda do mús-culo peitoral maior e pode ser uma fonte doadoraaceitável. Uma das desvantagens da utilização da veiaaxilar é o alto percentual de válvulas incompetentes.Quando transferidas para o membro inferior, são pro-pensas à dilatação e ao refluxo. Um revestimento dematerial sintético pode ser aplicado ao redor da válvulatransferida na tentativa de reduzir essa complicação33.Os resultados variam e alguns estudos referem taxas desucesso de 80%-90% em quatro anos de seguimento,enquanto outros referem taxas de 35%-45%37,38.Tratamento da úlceraA cicatrização da úlcera é feita em três fases histoló-gicas, descritas como: inflamatória, proliferativa e deremodelação cicatricial. A maioria das feridas tem sualesão fechada em 30 dias quando se trata da etiopatoge-nia e das complicações com curativos simples compres-sivos e com cuidados de higiene. Em alguns doentes,apesar dessa terapêutica básica, a lesão evolui cronica-mente, às vezes, arrastando-se por mais de um ano. Ocurativo fechado mantém o ambiente úmido, o queevita a formação de crosta e aumenta a velocidade damigração das células epiteliais, da síntese de colágeno,da formação do tecido de granulação e da angiogênese.Além disso, esses curativos mantêm um exsudato daferida rico em fatores de crescimento, que aceleram osprocessos cicatriciais14,39.As bandagens elásticas e inelásticas são efetivas. Odermatologista alemão Paul Unna, em 1885, introdu-ziu o uso de uma pasta à base de óxido de zincoassociado à compressão elástica para tratamento daúlcera varicosa, que é empregado até os dias de hoje. Omecanismo de ação da bota de Unna funciona tantoatravés da compressão elástica, permitindo que o paci-ente deambule, como através de ação tópica40,41.Vários curativos foram lançados nos últimos anos,desde modificações dos tradicionais curativos fechadosem pasta de Unna, gaze e esponjas absorventes commedicamentos impregnados até novos produtos combase em hidrocolóides, aglomerados de fibras de algina-to ou carvão ativado. Além de manter o ambiente dalesão apropriado, controlam sua hidratação, absorvemInsuficiência venosa crônica – França LHG et aliiPage 10J Vasc Br 2003, Vol. 2, Nº4327o excesso de secreção e evitam a maceração das bordasdas feridas. Atualmente, existem os chamados curativosbioativos, obtidos por engenharia genética e que atuamespecificamente em uma ou mais fases da cicatrização.Também estão sendo utilizados os equivalentes à pelehumana, formados por uma matriz protética de bovinopreenchida por queratinócitos e fibroblastos huma-nos14,42.A pentoxifilina, um agente hemorreológico, atua naprevenção da ativação dos leucócitos e na liberação deradicais livres, aumentando o aporte de oxigênio aostecidos. Colgan et al. realizaram estudo duplo-cegoprospectivo em 80 pacientes com úlcera de estase. Apósseis meses de tratamento com 1.200 mg/dia de pento-xifilina, 23 de 38 pacientes tiveram cicatrização com-pleta da úlcera. Dos pacientes que receberam placebo,apenas 12 de 42 tiveram a úlcera cicatrizada. Essadiferença foi estatisticamente significativa. Essa drogadeve ser usada como tratamento coadjuvante em asso-ciação com a compressão elástica42,43.Em pacientes com úlcera ativa, as evidências daeficácia da medicação ainda são limitadas. O diagnós-tico bacteriológico e o uso de antibióticos rotineira-mente não são recomendados, uma vez que não apre-sentam influência no diagnóstico, no tratamento e noprognóstico. Ressalva-se o uso de antibióticos nos casosde infecções com manifestações sistêmicas. O valor douso dos diversos tipos de tratamento local ainda não foicomprovado, sendo contra-indicado o uso de antibió-ticos tópicos15,39.Os pacientes portadores de úlceras venosas ativas erefluxo em junção safeno-femoral ou safeno-poplíteabeneficiam-se com o tratamento cirúrgico15.Embora a não adesão ao tratamento clínico seja acausa mais comum da não cicatrização da úlcera, outrascausas devem ser excluídas, principalmente a insufici-ência arterial. As infecções fúngicas e bacterianas devemser tratadas adequadamente e, em alguns casos, umabiópsia deve ser realizada para a exclusão de carcinomabasocelular ou escamoso39,44.Insuficiência venosa crônica – França LHG et aliiReferências1. Maffei FHA. Insuficiência venosa crônica: diagnóstico etratamento clínico. In: Maffei FHA, Lastória S, Yoshida WB.Doenças Vasculares Periféricas. Rio de Janeiro: Medsi; 1995.p. 1003-1011.2. Porter JM, Moneta LG. Reporting standards in venous disease:an update. J Vasc Surg 1995;21(4):635-45.3. Brand FN, Dannenberg AL, Abbott RD, Kannel WB. Theepidemiology of varicose veins: the Framingham study. Am JPrev Med 1988;4:96-101.4. Heit JA, Rooke TW, Silverstein MD, et al. Trends in theincidence of venous stasis syndrome and venous ulcer: a 25-year population-based study. J Vasc Surg 2001;33:1022-7.5. Maffei FHA, Magaldi C, Pinho SZ, et al. Varicose veins andchronic venous insufficiency in Brazil: Prevalence among1755 inhabitants of a country town. Int J Epidemiol 1986;15:210-7.6. Silva MC. Chronic venous insufficiency of the lower limbsand its socio-economic significance. Int Angiolol 1991;10(3):152-7.7. Scott TE, LaMorte WW, Gorin DR, Menzoian JO. Riskfactors for chronic venous insufficiency: a dual case-controlstudy. J Vasc Surg 1995;22:622-8.8. DePalma RG, Bergan JJ. Chronic venous insufficiency. In:Dean RH, Yao JST, Brewster D. Current Diagnosis &Treatment in Vascular Surgery. 1st ed. Norwalk, CT: Appleton& Lange; 1995. p. 365-374.9. Weingarten MS. State-of-the-art treatment of chronic venousdisease. Clin Infect Dis 2001;32(15):949-54.10. Burnand KG, Whimster I, Naidoo A, Browse NL. Pericapillaryfibrin in the ulcer-bearing skin of the leg: the cause oflipodermatosclerosis and venous ulceration. BMJ 1982;285:1071-2.11. Herrick SE, Sloan P, McGurk M, Freak L, McCollum CN,Ferguson MW. Sequential changes in histologic pattern andextracellular matrix deposition during the healing of chronicvenous ulcers. Am J Pathol 1992;285:1085-95.12. Thomas PR, Nash GB, Dormandy JA. White cell accumulationin dependent legs of patients with venous hypertension: apossible mechanism for trophic changes in the skin. Br MedJ (Clin Res Ed). 1988;296(6638):1693-5.13. Dormandy JA. Pathophysiology of venous leg ulceration: anupdate. Angiology 1997;48:71-5.14. Muraco Neto B. Estase venosa e cardiopatia – uma associaçãoincômoda. Rev Soc Cardiol Estado de São Paulo 1999;6:930-7.15. Castro e Silva M, Cabral ALS, Barros N Jr, Castro AA, SantosMERC. Normas de orientação clínica para o diagnóstico etratamento da insuficiência venosa crônica. Belo Horizonte:Sociedade Brasileira de Angiologia e Cirurgia Vascular –SBACV; 2001.16. Souza GG. Insuficiência venosa crônica. In: Pereira AH.Manual de Cirurgia Vascular. Rio de Janeiro: Revinter; 1998.p. 227-233.17. Ramelet AA, Monti M. Phlebology. The guide. Paris: Elsevier;1999.18. Kistner RL, Eklof B, Masuda EM. Classification of lowerextremity venous disease. In: Yao JST, Pearce WH. Progressin Vascular Surgery. Stamford, CT: Appleton & Lange; 1997.p. 423-431.19. Nicolaides AN, Hussein MK, Szendro G, Christopoulos D,Vasdekis S, Clarke H. The relation of venous ulceration withambulatory venous pressure measurements. J Vasc Surg1993;17:414-19.20. Owens LV, Farber MA, Young ML, et al. The value of airplethysmography in predicting clinical outcome after surgicaltreatment of chronic venous insufficiency. J Vasc Surg2000;32:961-8.Page 11328J Vasc Br 2003, Vol. 2, Nº435. Husni EA. Reconstruction of the veins: the need for objectivity.J Cardiovasc Surg (Torino) 1983;24(5):525-8.36. Neglen P, Berry MA, Raju S. Endovascular surgery in thetreatment of chronic primary and post-thrombotic iliac veinobstruction. Eur J Vasc Endovasc Surg 2000;20:560-71.37. Raju S, Fredericks RK, Neglen PN, Bass JD. Durability ofvenous valve reconstruction techniques for “primary” andpostthrombotic reflux. J Vasc Surg 1996;23:357-67.38. Bry JDL, Muto PA, O’Donnel TF, Isaacson LA. The clinicaland hemodynamic results after axillary-to-popliteal vein valvetransplantation. J Vasc Surg 1995;21:110-19.39. Thomaz JB. Úlcera de estase venosa: concepção etiopatogênicae terapêutica. In: Thomaz JB. Síndromes Venosas. Diagnósticoe Tratamento. Rio de Janeiro: Revinter; 2001. p. 355-367.40. Hendricks WM, Swallow RT. Management of stasis venousulcers with Unna’s boots versus elastic support stockings. J AmAcad Dermatol 1985;12(1 Pt 1):90-8.41. Cordts PR, Hanrahan LM, Rodriguez AA, Woodson J, LaMorteWW, Menzoian JO. A prospective, randomized trial of Unna’sboot versus Duoderm CGF hydroactive dressing pluscompression in the management of venous leg ulcers. J VascSurg. 1992;15(3):480-6.42. Dormandy JA. Pharmacologic treatment of venous leg ulcers.J Cardiovasc Pharmacol 1995;25 Suppl 2:61-5.43. Colgan MP, Dormandy JA, Jones PW, Schraibman IG,Shanik DG, Young RA. Oxpentifylline treatment of venousulcers of the leg. BMJ 1990;300:972-5.44. Abou-Zamzam AM, Moneta GL. Deep vein insufficiency:evaluation and conservative management. In: Cronenwett JL,Rutherford RB. Decision Making in Vascular Surgery.Philadelphia: W. B. Saunders Co.; 2001. p. 294-297.Insuficiência venosa crônica – França LHG et alii21. Evangelista SSM. Pletismografia no estudo das doenças venosas.In Maffei FHA, Lastória S, Yoshida WB, Rollo HA. DoençasVasculares Periféricas. Rio de Janeiro: Medsi; 2002.22. Pittler MH, Ernst E. Horse chestnut seed extract for chronicvenous insufficiency. Cochrane Database Syst Rev. 2002;(1):CD003230.23. Mashour NH, Lin GI, Frishmann WH. Herbal medicine forthe treatment of cardiovascular disease: clinical consideration.Arch Intern Med 1998;158(20):2225-34.24. Laurent R, Gilly R, Frileux C. Clinical evaluation of a venotropicdrug in man. Example of Daflon 500 mg. Int Angiol 1988;7Suppl 2:39-43.25. Widmer L, Biland L, Barras JP. Doxium 500 in chronicvenous insufficiency: a double-blind placebo controlledmulticentre study. Int Angiol 1990;9:105-110.26. Hallet JW Jr., Brewster DC, Rasmussen TE. Postphlebiticsyndrome and chronic venous insufficiency. In: Hallet JW Jr.,Brewster DC, Rasmussen TE. Handbook of Patient Care inVascular Diseases. 4th ed. Philadelphia: Lippincott Williams& Wilkins; 2001. p. 269-76.27. Labropoulos N, Tassiopoulos AK, Kang SS, Mansour MA,Littooy FN, Baker WH. Prevalence of deep venous reflux inpatients with primary superficial vein incompetence. J VascSurg 2000;32:663-8.28. Saharay M, Scurr JH. Minimally invasive surgery for perforatorvein incompetence. Cardiovasc Surg 1996;4(6):701-5.29. Cockett FB. Indications for and complications of the ankleperforator exploration. Phlebology 1988;3:3-6.30. Linton RR. The communicating veins of the lower leg and theoperative technique for their ligation. Ann Surg 1938;107:582-93.31. Wilkinson GE, Maclaren IF. Long-term review of proceduresfor venous perforator insufficiency. Surg Gynecol Obstet1986;163:117-20.32. Rhodes JM, Gloviczki P. Endoscopic perforating vein surgery.Surg Clin North Am 1999;79(3):667-81.33. Raju S. Surgical treatment of deep venous valvularincompetence. In: Rutherford RB. Vascular Surgery. 5th ed.Philadelphia: W. B. Saunders Co.; 2000. p. 2037-49.34. Gloviczki P, Cho J. Surgical treatment of chronic deep veinobstruction. In: Rutherford RB. Vascular Surgery. 5th ed.Philadelphia: W. B. Saunders Co.; 2000. p. 2049-2066.Correspondência:Dr. Luís Henrique Gil FrançaRua Coronel Dulcídio, 1189/1801CEP 80250-100 - Curitiba - PRTel.: (041) 343.0963E-mail: luishgf@hotmail.comO conteúdo do J Vasc Br está disponível em português e em inglêsno site do Jornal Vascular Brasileiro emwww.jvascbr.com.br
posted by jaurib at 5:51 AM 0 comments
Tuesday, November 07, 2006
Profilaxia de Trombose Venosa Crônica
UTI TROMBOSE VENOSA PROFUNDA - TVP

Simpósio ABC de Tromboembolismo Pulmonar
Trombose Venosa Profunda. Profilaxia
Antonio Claudio do Amaral Baruzzi, Amit Nussbacher, Sofia Lagudis, José Augusto Marcondes Souza
Hospital Israelita Albert Einstein - São Paulo,SP.
Arquivos Brasileiros de Cardiologia 67(3):, 1996
A profilaxia da trombose venosa profunda (TVP) é muito importante porque é a principal causa da embolia pulmonar (EP). Na maioria das vezes, a TVP é assintomática e sua primeira manifestação clínica pode ser o tromboembolismo pulmonar (TEP), por vezes fatal. Apesar da comprovada eficácia da profilaxia, quanto à prevenção do TEP, esta ainda tem sido pouco utilizada, mesmo em hospitais do primeiro mundo. Goldhaber e col 1 estimaram que somente 30% dos pacientes hospitalizados e de risco para TVP recebiam profilaxia adequada no Brigham and Women's Hospital, de Boston (EUA).
Nos Estados Unidos, a TVP é responsável por 300.000 a 600.000 internações/ano, sendo que o TEP causa ou contribui para a morte em 12% dos pacientes hospitalizados. Dados pouco conhecidos em nosso meio 2.
Os métodos de profilaxia, farmacológicos ou não-farmacológicos, devem ser individualizados e aplicados, conforme o grau de risco para TVP. Mesmo após a alta hospitalar, deve ser mantida entre os que ainda apresentam algum risco de TVP.
Localização dos trombos
Os trombos são compostos por fibrina e elementos figurados do sangue e podem se formar no sistema arterial, venoso, coração e na microcirculação. Os arteriais formam-se num sistema de alta pressão e fluxo e compõem-se, principalmente, de plaquetas e fibrina. Os venosos formam-se em áreas de estase, são ricos em hemácias, fibrina e pobres em plaquetas.
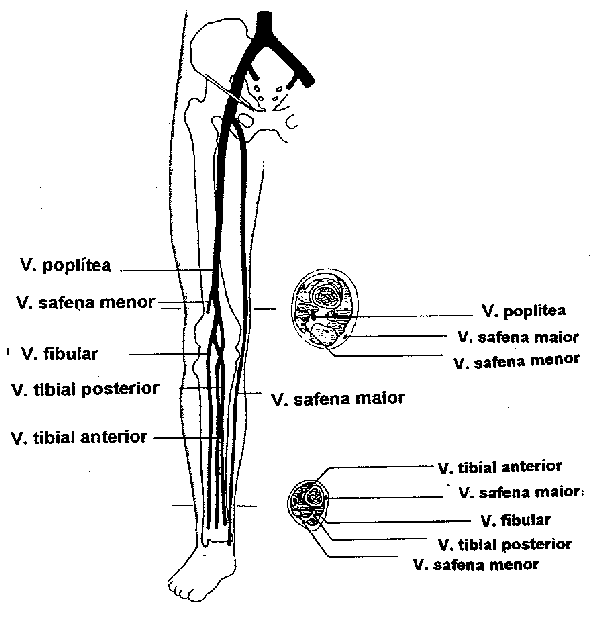
Fig. 1 - Sistema venoso profundo.
A análise do trombo demonstra linhas claras (camadas de plaquetas e fibrina), interpostas com linhas escuras (camadas de eritrócitos), denominadas de estrias de Zahn 3. A ativação da cascata da coagulação é o mecanismo principal da patogênese da TVP, sendo a ativação plaquetária menos importante, justificando a ação mais benéfica dos anticoagulantes, tanto na profilaxia quanto no tratamento, mais do que os antiagregantes plaquetários. O plano valvar do sistema venoso profundo dos membros inferiores é o local onde geralmente inicia a sua formação. A extensão do trombo ocorre na direção do fluxo sangüíneo pela deposição de sucessivas camadas, entretanto, os seus segmentos flutuantes proximais podem se fragmentar com risco de embolização para os pulmões.
A maioria dos trombos dos membros inferiores localiza-se nos vasos distais (abaixo da veia poplítea), porém, podem se propagar para os segmentos proximais (veia poplítea, femoral, ilíaca, cava). Os principais sinais e sintomas da TVP são: 1) os inflamatórios da parede do vaso (dor à palpação e dorsiflexão do pé - sinal de Homans, dor à compressão da panturrilha pelo esfigmomanômetro - sinal de Lowenberg); 2) edema pela estase venosa e 3) os embólicos pela fragmentação do trombo.
O termo flegmasia alba dolens refere-se a palidez e edema do membro causada pela associação da trombose venosa ileofemoral e espasmo arterial. O edema pode aumentar de intensidade e placas azuladas surgem na pele. Flegmasia cerulea dolens é aplicada ao caso raro de marcado edema e cianose do membro inferior devido a trombose ileofemoral. A cianose é secundária a severidade da oclusão venosa, envolvendo, geralmente, os vasos da coxa, veia safena e comunicantes. O edema pode ser de tal intensidade que impede o fluxo arterial e causa isquemia. A apresentação é dramática, com dor, cianose, edema e petéquias hemorrágicas, com elevada morbidade e mortalidade 4.
O diagnóstico diferencial da TVP inclui, por exemplo, dor de origem músculo-esquelética, cisto inflamatório poplíteo (cisto de Baker), afecções linfáticas e tromboflebite. Trombos isolados das panturrilhas são geralmente assintomáticos. Se não tratados, 20 a 30% podem se estender para os vasos mais proximais, com risco de TEP (fig. 1).
A principal fonte embolígena são os vasos venosos profundos da coxa, pelvis e poplíteo (vasos do sistema cava inferior), seguida da câmara cardíaca direita e vasos oriundos da veia cava superior (fig. 2).
História natural
As duas principais complicações da TVP são a EP e a síndrome pós-TVP, cuja maior seqüela é a hipertensão venosa, secundária à obstrução venosa residual e insuficiência valvar. Esta, geralmente, decorre da lise ou recanalização incompleta do trombo e se desenvolve ao longo de vários meses e pode se desenvolver mesmo em segmentos venosos não diretamente envolvidos no processo trombótico, sugerindo que o mecanismo pela qual a insuficiência valvar ocorre pós-TVP, não é conseqüência apenas do efeito físico do trombo sobre a valva.
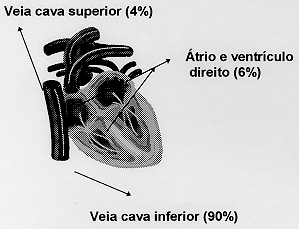
Fig. 2 - Principais fontes embolígenas no TEP.
A incidência da insuficiência valvar é muito reduzida naqueles indivíduos que apresentam lise precoce do trombo, o que contribui para preservar a função valvar, do contrário, a persistência da obstrução aumenta sua gravidade. Outra complicação da TVP é o TEP, responsável por elevado número de óbitos 2.
Se a restauração da circulação pulmonar for parcial, haverá risco de evolução para hipertensão pulmonar (HP) crônica, cuja sobrevida será reservada em 10 anos. O uso de trombolíticos no TEP poderá promover a lise do trombo e restabelecer a circulação pulmonar com conseqüente redução da HP e melhora da função do ventrículo direito. Além disso, a sua ação sobre os trombos venosos profundos poderá também reduzir os riscos da síndrome pós-TVP 5-7.
Fatores de risco
Dentre os fatores de risco, já citados, quando associados, podem ter efeito sinérgico com aumento de risco para TVP. Em unidades de terapia intensiva, por exemplo, a associação de politrauma, cirurgia de grande porte e lesão vascular é de alto risco para TVP e evolução para TEP. A classificação do risco conforme os fatores predisponentes 8,9 estão na tabela I.
Profilaxia
Todo paciente de risco para TVP e TEP deve receber alguma forma de profilaxia, que pode ser feita através de medidas farmacológicas, não farmacológicas ou associação de ambas 10-16.
Profilaxia não farmacológica
Meias elásticas - As meias de compressão gradual, 18mmHg nos tornozelos, 14mmHg nas panturrilhas, 8mmHg no joelho e 10mmHg na porção distal da coxa e 8mmHg na proximal produz aumento de 36% na velocidade de fluxo da veia femoral. Quando a compressão é uniforme de 11mmHg, este aumento é de apenas 10%. Entre os pacientes de baixo risco, reduz a freqüência de TVP em mais de 50% se comparado com aqueles sem profilaxia. Seu uso precoce associado a deambulação e a movimentação dos membros inferiores é a primeira medida profilática a ser adotada entre os pacientes hospitalizados.
| | Risco baixo | Risco moderado | Risco alto |
|---|---|---|---|
| Cirurgia geral | Idade <40> | Idade >40 anos | Idade >40 anos |
| | Duração <60min> | Duração >60min | duração <60min> |
| Cirurgia ortopédica | - | - | Artroplastia joelho ou quadril |
| Trauma | - | - | Lesões extensas partes moles, fraturas osso longo ou múltiplas, politrauma |
| Condição clínica | Gravidez | IAM, ICC, DPOC, DM descompensado, AVCI, puerpério, antecedente de TVP/TEP | Acidente vascular cerebral, paralisia dos membros |
| % de evento tromboembólico (sem profilaxia) TVP distal | 2 | 10-40 | 40-80 |
| TVP proximal | 0,4 | 2-8 | 10-20 |
| TEP sintomático | 0,2 | 1-8 | 5-10 |
| TEP fatal | 0,002 | 0,1-0,4 | 1-5 |
IAM- infarto agudo do miocárdio; ICC- insuficiência cardíaca congestiva; DPOC- doença pulmonar obstrutiva crônica; DM- diabetes mellitus, AVCI- acidente vascular cerebral isquêmico; * o risco está aumentado quando associado: idade maia elevada, obesidade, repouso no leito prolongado, varizes, uso de estrógeno.
Compressão pneumática intermitente - A compressão do membro inferior pela insuflação seqüencial de cuffs: 35, 30 e 20mmHg, respectivamente, no tornozelo, joelho e coxa aumentam em 240% a velocidade de fluxo na veia femoral. Quando somente uma câmara é utilizada, no tornozelo, com pressão de 35mmHg por 12s, este aumento é de 180%. O tempo de clareamento do contraste da venografia é oito vezes menor quando comparado ao de compressão seqüencial. Há evidências que esta modalidade de profilaxia aumente a atividade fibrinolítica endógena.
Filtro de veia cava inferior - Indicado em situações especiais, por exemplo, naqueles com contra-indicação para profilaxia farmacológica e com alto risco de TEP. O portador de fratura ortopédica com fenômeno tromboembólico recente e necessidade de tratamento cirúrgico, pode se beneficiar do mesmo. É medida eficaz na prevenção do TEP e não atua sobre a cascata da coagulação. Migração do filtro, estase venosa crônica e TEP através de vasos colaterais, são algumas das complicações. Filtro temporário (duração de até 14 dias) com sua retirada após comprovação de ausência de trombo é outra opção profilática.
Profilaxia farmacológica
Heparina não fracionada (HNF) (liquemineR, heparinaR) - Descoberta em 1916, a heparina é um polissacáride natural, extraído da mucosa intestinal de porco. Tem peso molecular (PM) de 3.000 a 30.000 daltons (PM médio de 15.000 daltons). Seu efeito anticoagulante baseia-se no fato de interagir com a antitrombina III, promovendo alteração na sua conformação estrutural, o qual acelera sua capacidade em inativar várias enzimas da cascata da coagulação: fator XIIa, fator XIa, fator IXa, fator Xa e fator IIa (trombina) (fig. 3). Destes, a trombina e o fator Xa são os mais sensíveis à inibição. Somente um terço da heparina infundida por via endovenosa liga-se à antitrombina III (ATIII), promovendo seu efeito anticoagulante. O restante liga-se a ao fator von Willebrand, células endoteliais, macrófagos. É clareada através de receptores situados no endotélio e macrófagos, onde é internalizada e despolimerizada e, também, pelos rins. Na profilaxia utilizam-se doses de 5.000 a 7.500UI de heparinato de cálcio ou de sódio cada 8 a 12h, via SC.
Heparina de baixo peso molecular (HBPM) (nadroparina - fraxiparineR; enoxaparina - clexaneR) - É obtida através da despolimerização da heparina com produção de fragmentos de PM entre 4.000 e 6.000 daltons. Tem maior capacidade em inibir o fator Xa e menor afinidade por proteínas plasmáticas, vasculares, células endoteliais, macrófagos e plaquetas, conferindo maior biodisponibilidade e meia-vida plasmática e redução dos efeitos colaterais relacionados a plaquetopenia e risco de sangramento. Para os pacientes de risco moderado recomenda-se: 1) enoxaparina SC 20mg (2.000UI anti-Xa) 2h antes da cirurgia e mantido por sete a 10 dias (ou enquanto persistir o risco) ou nadroparina 0,3ml SC (7.500UI anti-Xa), nos mesmos intervalos de tempo. Para os de alto risco: enoxaparina 40mg SC 12h antes da cirurgia e mantido por sete a 10 dias ou nadroparina 0,6mL SC, nos mesmos intervalos.
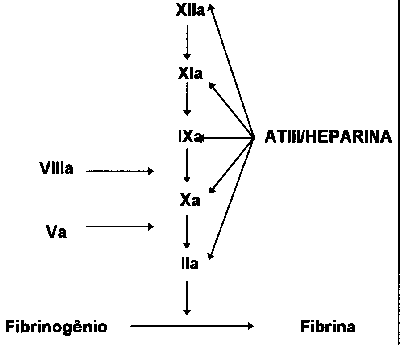
Fig. 3 - O complexo heparina/ATIII inativa os fatores da coagulação XIIa, XIa, Ixa, Xa e trombina (IIa). Trombina e fator Xa são os mais sensíveis aos seus efeitos. Dextran 40 - reduz a adesividade e a agregação plaquetária. Utilizar doses de 500mL EV durante seis a 24h e mantido por alguns dias. Pode causar insuficiência cardíaca pelo efeito da expansão plasmática, anafilaxia (1:40.000) e insuficiência renal). Útil naqueles com risco de sangramento pela heparina.
Nas obstruções de cateteres venosos, pode ser utilizado o fibrinolítico uroquinase (abbokinase open-cathR), na dose de 5.000UI, injetados dentro do cateter. Aspirar após 30min e repetir a dose caso não tenha ocorrido sucesso.
As medidas farmacológicas e não farmacológicas da TVP conforme o risco estão na tabela II.
Na gravidez a profilaxia deve ser feita com HNF ou com a HBPM, pois não atravessam a placenta e não são teratogênicos 17. No trauma medular, a incidência de TVP é maior nas duas primeiras semanas seguintes ao mesmo e mais raro após o 3º mês. Recomenda-se o uso profilático da HBPM por pelo menos três meses ou HNF associada a medidas não farmacológicas 18. Naqueles submetidos a neurocirurgia intracraniana, a profilaxia não farmacológica tem sido recomendada, embora a sua associação com a HNF tem sido sugerida 19.
| Risco baixo | Risco moderado | Risco alto |
|---|---|---|
| Não farmacológica | Enoxaparina 20mg SC ou Nadroparina 0,3mL SC 2h antes da cirurgia seguida de aplicação diária enquanto persistir o risco. Heparina 5.000UI SC(2x/dia) associado ou não a medidas não farmacológicas. | Enoxaparina 40mg SC ou Nadroparina 0,6mL SC l2h antes da cirurgia seguida de aplicação diária enquanto persistir o risco. Heparina 5.000UI SC (3x/dia) associado ou não a medidas não farmacológicas |
Nos portadores de cateteres venosos centrais, a prevenção da trombose da veia subclávia e axilar deve ser feita com warfarin na dose de 1mg/dia. Nos pacientes submetidos a cirurgia de revascularização miocárdica e que não recebem profilaxia para TVP, cerca de 4% apresentam TEP 20. Em um estudo utilizando a ultra-sonografia dos membros inferiores para a detecção de TVP em pacientes submetidos a revascularização miocárdica e que não eram portadores de doença vascular periférica, constataram que 20% dos casos apresentaram TVP apesar da profilaxia com medidas não farmacológicas (meias elásticas e/ou compressão pneumática). O TEP ocorreu em 0,6% dos casos, sendo um fatal 21. O uso da HBPM nesses casos tem sido motivo de controvérsia devido ao risco de sangramento, principalmente no período mais imediato do pós-operatório 22.
Referências
1. Goldhaber SZ - Practical aspects of venous thromboembolism prevention. An overview. Cardiovasc Res 1994; 10: 34-43.
2. Alpert JS, Dalen J - Epidemiology and natural history of venous thromboembolism. Prog Cardiovasc Dis 1994; 36: 417-46.
3. Morpurgo M, Schmid C - The spectrum of pulmonary embolism. Chest 1995; 107: 18S-20S.
4. Stephen J, Feied C - Venous thrombosis. Postgrad Med 1995; 97: 36-47.
5. Baruzzi ACA, Knobel E, Cirenza C et al - Repercussões da terapia trombolítica no tromboembolismo pulmonar agudo. Arq Bras Cardiol 1995; 64: 515-20.
6. Wolfe MW, Skibo l, Goldhaber SZ - Pulmonary embolic disease: Diagnosis, pathophysiologic aspects and treatment with thrombolytic therapy. Curr Probl Cardiol 1993; 18: 587-633.
7. Camerota AJ - Thrombolytic therapy for acute deep vein thrombosis. In: Camerota AJ - Thrombolytic Therapy for Peripheral Vascular Disease. Philadelphia: JB Lippincott, 1995; 175.
8. Weinmann EE, Salzman E - Deep-vein thrombosis. N Engl J Med 1994; 331: 1630-40.
9. Salzman EW, Hirsh J - Prevention of venous thromboembolism. In: Colman RW, Hirsh J, Marder VJ - Hemostasis and Thrombosis: Basic Principles and Clinical Practice, 3rd ed. Philadephia: JB Lippincott, 1994; 1332.
10. Clagett GP, Anderson Jr FA, Heit J et al - Prevention of venous thrombosis. Fourth ACCP Consensus Conference on Antithrombotic Therapy. Chest 1995; 108: 312S-34S.
11. Hirsh J, Fuster V - Guide to anticoagulant therapy. Circulation 1994; 89: 1449-79.
12. Kakkar V, Cohen A, Edmonson R et al - Low molecular weight vs standard heparin for prevention of venous thromboembolism after major abdominal surgery. Lancet 1993; 341: 259-65.
13. Geerts W, Code K, Jay RM et al - A prospctive study of venous thromboembolism after major trauma. N Engl J Med 1994; 331: 1601-6.
14. Baker WF - Outcome analysis for treatment in 100 patients with deep vein thrombosis. Clin Appl Tromb Hemost 1995; 1: 39-47.
15. Spiro TE, Johnson GJ, Christie M et al - Efficacy and safety of enoxaparin to prevent deep venous thrombosis after hip replacement surgery. Ann Intern Med 1994; 121: 81-9.
16. Knudson M, Lewis FR, Clinton A et al - Preventions of venous thromboembolism in trauma patients. J Trauma 1994; 32: 2-11.
17. Ginsberg JS, Hirsh J - Use of antithombotic agents during pregnancy. Fourth ACCP Consensus Conference on Antithrombotic Therapy. Chest 1995; 108: 305S-11S.
18. Freen D, Hull RD, Mammen EF et al - Deep vein thrombosis in spinal cord injury. Summary and recommendations. Chest 1994; 102: 633S-5S.
19. Frim DM, Barker FG, Poletti CS et al- Postoperative low-dose heparin decreases thromboembolic complications in neurosurgical patients. Neurosurgery 1992; 30: 830-3.
20. Josa M, Siouffi SY, Silverman AB et al - Pulmonary embolism after cardiac surgery. J Am Coll Cardiol 1993; 21: 990-6.
21. Goldhaber SZ, Hirch D, MacDougall C et al - Prevention of venous thrombosis after coronary artery bypass surgery (a randomized trial comparing two mechanical prophylaxis strategies). Am J Med 1995; 76: 993-6.
22. Reis SE, Polak JP, Hirsh DR et al - Frequency of deep venous thrombosis in asymptomatic patients with coronary artery bypass grafts. Am Heart J 1991; 122: 478-82.
Anticoagulantes, Inibidores Plaquetários e Trombolíticos
Introdução
A natureza desenvolveu sistemas engenhosos para manter a fluidez do sangue , permitindo porém que haja uma rápida formação de um tampão sólido , sempre que surja a necessidade de tamponamento de uma solução de continuidade no sistema vascular. O perfeito funcionamento desse mecanismo depende basicamente de 3 componentes : 1) a parede vascular, incluindo o endotélio e tecido sub-endotelial; 2)plaquetas e 3)proteínas solúveis pró- coagulantes , anti-coagulantes e fibrinolíticas.
Inúmeras alterações neste complicado sistema podem predispor a formação de trombos ou levar a ocorrência de hemorragias . Na prática clínica situações onde uma inibição dos agentes pró-coagulantes precisam ser obtidas estão entre as mais freqüentes, e para tanto é necessário o conhecimento das características das principais drogas disponíveis para este fim .
Fisiologia
Endotélio
O endotélio normal possui uma superfície anti-trombótica. Os mecanismos responsáveis por esta "tromborresistência" são decorrentes do isolamento que o endotélio confere às substâncias trombogênicas do sub-endotélio , bem como produção ativa de substâncias pró e anticoagulantes por parte das células endoteliais.
Plaquetas
As plaquetas têm um papel central na hemostasia normal . Nos locais de lesão endotelial as plaquetas ,através do fator de von Willebrand, ligam-se aos elementos subendoteliais (Fig.2) , particularmente o colágeno. As plaquetas liberam várias substâncias ativas e inicia-se o processo de adesão plaquetária (Fig.1). Este tampão plaquetário é conhecido como tampão primário. Estas plaquetas sob ação do ADP , tromboxano e trombina se contraem , originando o tampão secundário. As plaquetas ativadas ao rearranjar as suas lipoproteinas expõe determinados fosfolipídeos , onde os fatores de coagulação podem se concentrar. As plaquetas ativadas aceleram a formação de trombina. A trombina ocupa uma porção central no processo de coagulação , ela é formada como resultado de uma cadeia de reações que ocorrem principalmente na membrana das plaquetas , de outras células ativadas, e no fator tissular (uma proteína de membrana que é exposta à corrente sangüínea em algumas situações) , onde os fatores de coagulação se ligam. O processo de coagulação é finalizado com o desencadeamento da cascata de coagulação e culmina com a deposição de fibrina . Esta cascata é esquematicamente dividida em via "Intrínseca" e via "Extrínseca".
Fig 1. Eventos após a ativação plaquetária. A plaqueta secreta várias substâncias ativas: vWF (fator de von Willebrand) ; ADP (adenosina di-fosfato) ; PDGF (fator de crescimento derivado da plaqueta). O processo culmina com a adesão e agregação plaquetária.
A via Intrínseca
Todos os fatores participantes da via intrínseca estão presentes no sangue circulante, e a reação em cadeia é desencadeada pelo contato com plaquetas ativadas ou componentes do tecido subendotelial.. A fase inicial envolve a interação entre o fator XII (Hageman) , pré-calicreina e o cininogênio de alto peso molecular , apesar do mecanismo exato ainda não seja conhecido. O fator XII circula no plasma ; sua cadeia leve tem uma grande afinidade por superfícies negativamente carregadas. O fator XII ativado converte o próximo fator da coagulação de sua forma zimogênica (fator XI) para sua forma enzimática XIa. O fator XIa , em uma reação cálcio dependente, ativa o fator IX. O fator IX ativado juntamente com o fator VIII e o cálcio , formam um complexo que ativam o fator X (Fig.1).
Fig.2 - A adesão plaquetária ao sub-endotélio é facilitada pelo FvW , que forma uma ponte entre os receptores GpIb-IX das plaquetas e o colágeno sub-endotelial. Aadesão entre as plaquetas é feita através dos receptores GpIIb-IIIa , intermediado pelo fibrinogênio.
A via Extrínseca
Na via extrínseca , um fator tissular inicia a cadeia de eventos ao formar um complexo com o fator VII . O complexo fator tissular-Fator VIIa ativa primariamente o fator X , mas também os fatores IX e XI , o que interliga as vias intrica e extrínseca . Deve ser notado que fosfolipídeos da parede plaquetária , juntamente com o fator Xa , podem ativar o fator VII, sendo uma outra ponte de ligação entre as vias intrínseca e extrínseca. Logo percebe-se que os conceitos de prévios de duas vias distintas estão tornando-se obsoletos.
A via Comum
O Fator X encontra-se na intercessão das então chamadas vias intrínseca e extrínseca . A presença do fator VIIIa aumenta em até 10000 vezes a taxa de ativação do fator X pelo fator IX, o fator VIII é então um co-fator muito importante. Para ser totalmente ativo o fator Xa deve formar um complexo com o fator Va , o que aumenta em 300.000 vezes a ativação da protrombina por parte do fator Xa . A trombina age então convertendo o fibrinogênio em fibrina, que é o resultado final da cascata de coagulação.
Fig. 3- Cascata da coagulação. Vias intrínseca e extrínseca , ação das proteínas anticoa-gulantes (proteína C e S) e antitrombina III sob ação da heparina.
Estímulos Anti-Coagulantes
A fluidez do sangue é mantida pelo próprio fluxo sangüíneo , que reduz a concentração dos fatores pró-coagulantes, pela adsorsão de fatores de coagulação e pela presença de múltiplos inibidores plasmáticos : antitrombina, proteína C e S, e o inibidor da via do fator tissular são os inibidores mais importantes e, coletivamente mantém a fluidez do sangue.
Os inibidores plasmáticos agem através de mecanismos diversos. A antitrombina forma complexos com todos fatores de coagulação proteases de serina, exceto com o fator VII . A proteína C , depois de ligada a uma proteína da célula endotelial chamada trombomodulina, é convertida pela trombina em uma protease ativa. A proteína C ativada tem a capacidade de inibir os fatores V e VIII por meio de uma proteólise que lentifica duas reações essenciais da coagulação. A ação da proteína C é facilitada pela proteína S . A deficiência de qualquer uma dessas proteínas leva, como se poderia prever, a estados de hipercoagulabilidade.
Drogas
Anti-coagulantes
Heparina não-Fracionada
O termo heparina refere-se a uma família de mucopolissacarídeos com cadeias de tamanho variável. A ação anti-coagulante da heparina é obtida através da ligação com dois anti-coagulantes naturais , a antitrombina III , um inibidor da trombina , fator X, IX e XI , e o co-fator II da heparina, que age apenas inibindo a trombina . A ligação da heparina com a antitrombina III aumenta a atividade deste fator em 1000 vezes . O fator Xa ligado as plaquetas, e a trombina ligada ao endotélio estão protegidas contra a inibição da antitrombina III. No plasma , uma quantidade aproximadamente 20 vezes maior de heparina é necessária para inativar a trombina ligada à fibrina em relação a trombina livre . As plaquetas também interferem com a função da heparina de outra forma, elas secretam um fator inibidor da heparina , o fator plaquetário IV. Estas características explicam porque é necessário uma quantidade maior de heparina para prevenir a extensão de um trombo que para a prevenir a formação inicial deste trombo .
A heparina não é absorvida pelo trato gastrointestinal , logo sua única via de administração é a parenteral . No sangue , além das proteínas , a heparina também se liga às células endoteliais e monócitos . Os diferentes níveis de heparina ligada as proteínas são responsáveis pelas diferenças das doses de heparina necessárias para se alcançar o objetivo terapêutico entre indivíduos diferentes . Isso também explica a resistência a heparina que alguns indivíduos apresentam, principalmente os que apresentam níveis elevados de proteínas da fase aguda . Por conta dessas características a biodisponibilidade da heparina é variável , e respostas diferentes são obtidas em pacientes diferentes , e até no mesmo paciente em momentos diferentes , com administração de doses fixas de heparina .
A farmacocinética da heparina é complicada , estando condicionada a muitas variáveis , sua meia-vida é dose dependente . A sua ação anti-coagulante aumenta desproporcionalmente em duração e intensidade com o aumento da dose, isso exige um manejo cuidadoso desta droga e uma monitorização de sua ação. O teste mais utilizado para monitorização e ajuste do tratamento anti0coagulante da heparina é o Tempo de Tromboplastina Parcial (TTPa) . O TTPa é mensurado adicionando tromboplastina parcial (uma mistura de fosfolipídeos), uma substância ativadora, e cloreto de cálcio ao plasma citratado. Este teste exibe o ramo da via intrínseca da coagulação. Apesar das diferenças entre os regentes laboratoriais usados para medir o TTPa , a heparinização plena exige que o TTPa esteja aproximadamente 1,5 a duas vezes o valor basal . Técnicas mais precisas para a monitorização da heparinização podem ser obtidas através da determinação dos níveis plasmáticos de heparina ou do fator Xa.
A principal complicação do uso da heparina é a hemorragia , que pode ocorrer mesmo com monitorização adequada dos parâmetros da coagulação. O sítio do sangramento é variável podendo ocorrer no trato gastrointestinal, urinário , pele , glândula supra renal ou outros locais. O risco de sangramento é maior quando se usa heparina intravenosa intermitente (14,2%) em relação a infusão contínua (6,8%) ou via subcutânea (4,1%).
Trombocitopenia induzida por heparina é outro efeito relativamente comum. Ela pode ocorrer de forma transitória e imediata, logo após o início da infusão devido a ação direta sobre as plaquetas causando uma agregação plaquetária . A plaquetopenia persistente , ocorre mais tardiamente , cerca de 10 dias após o início do tratamento e remite cerca de 6 dias após interrupção do tratamento. Reações de anafilaxia ao uso da heparina também podem ocorrer. Pode ocorrer hiperpotassemia em conseqüência de uma inibição da secreção da aldosterona pela supra renal , por um mecanismo ainda não esclarecido . Complicações mais raras com o uso da heparina envolvem : alopecia, necrose cutânea , aumento das enzimas hepáticas. Osteoporose ocorre nos casos de uso crônico de heparina.
Heparina de Baixo peso Molecular
A heparina de baixo peso molecular (HBPM) surgiu como uma opção frente às limitações da heparina não fracionada. Na verdade as HBPMs são fragmentos de heparina não fracionada , obtidas através de reações de depolimeração química ou enzimática controladas. Elas são chamadas de HBPM devido ao seu baixo peso (5000 a 15.000) em relação à heparina não fracionada (3000 a 40.000) . O mecanismo de ação da HBPM é semelhante ao da heparina não fracionada. A ligação da HBPM a antitrombina III ocorre através da mesma seqüência de pentassacarídeos presentes na heparina não fracionada. A HBPM age inibindo apenas o fator Xa , para que ocorra a inibição da trombina é necessário a presença de uma cadeia adicional ,presente apenas na heparina não fracionada, o que não é verdade para a inibição do fator Xa. A importância relativa da inibição da trombina e do fator Xa ainda não está clara, mas há evidências que ambos são importantes. In vitro, a trombina desempenha uma papel mais importante , porque a inibição da trombina previne a ativação dos fatores V e VIII por feedback..
As vantagens da HBPM em relação as heparinas não fracionadas são várias. A HBPM produz um efeito mais previsível , refletindo sua melhor biodisponibilidade , maior meia vida , e seu clearance dose independente.
O fator Xa ligado a membrana plaquetária é resistente à inativação pela heparina não fracionada , mas não a inativação pela HBPM. A HBPM possui uma menor afinidade a ligação ao endotélio, ao fator plaquetário IV assim como as outras proteínas, o que lhe confere uma maior biodisponibilidade. A meia-vida da heparina de baixo peso molecular é maior que a heparina não fracionada (atividade anti-Xa entre 3 e 4 horas para HBPM versus 30 a 150min para heparina não fracionada), além de apresentar menor variabilidade individual.
A HBPM possuem uma menor afinidade ao fator de von Willebrand, aumentam menos a permeabilidade vascular que a heparina não fracionada , e tem pouco efeito sobre as plaquetas. Essas diferenças poderiam explicar porque , em doses equivalentes, a HBPM produz menos episódios de sangramento que a heparina não fracionada em animais de laboratório. A maior meia vida da HBPM e sua biodisponibilidade e efeito mais previsíveis permitem o tratamento utilizando doses únicas subcutâneas , sem monitorização.
Em relação aos efeitos colaterais a HBPM apresenta algumas vantagens em relação a heparina não fracionada . A trombocitopenia e a osteoporose ocorrem menos freqüentemente com a HBPM , além do menor risco de sangramento . A HBPM é atualmente a droga ideal para se utilizar em mulheres grávidas. Assim como a heparina não fracionada a HBPM pode ser antagonizada pelo uso de protamina, o efeito anti-Xa porém , é apenas parcialmente revertido, provavelmente porque a protamina não consegue se ligar as cadeias muito pequenas da heparina de baixo peso molecular.
Anticoagulantes Orais
Os anticoagulantes são derivados da 4-hidroxicumarina (cumarínicos) ou do indan-1,3-diona (compostos indandiônicos) . Warfarin sódico e os outros cumarínicos são anticoagulantes orais, lipossolúveis , ativos apenas in vivo , que exercem sua ação impedindo a ativação da vitamina K pela epoxi-redutase. A característica comum dos cumarínicos é o núcleo de 4-hidroxicumaria. Os diversos compostos que fazem parte deste grupo (warfarin sódico, acenomurol, fenprocoumon ou hidroxicumarina) diferem entre si em relação a velocidade de inibição da epóxi-redutase. Em sua faixa terapêutica os cumarínicos encontram-se ligados apenas a albumina , ligação esta que encontra-se diminuida no estado urêmico. Estes compostos não atravessam a barreira hematoencefálica, porém atravessam a placenta , possuindo efeito teratogênico, além de estar presente no leite materno. O warfarin sofre metabolização hepática, gerando metabólitos pouco ativos, através da conjugação com ácido glicurônico. A meia vida desta droga é dose independente , com variação considerável entre indivíduos, podendo oscilar entre 35 e 45 horas.
A ação dos anticoagulantes orais é decorrente da inibição da síntese dos fatores de coagulação vitamina K-dependente (fatores II, VII, IX e X) além de duas outras proteínas anticoagulantes naturais (proteína C e S). A concentração plasmática destas proteínas caí de acordo com a meia vida de cada uma . Das proteínas que dependem da vitamina K , as que apresentam menor meia vida são a proteína C e o fator VII , o que explica um efeito pró-coagulante inicial dos anticoagulantes orais devido a deficiência da proteína C.
Os anticoagulantes orais apresentam efeitos potencialmente tóxicos e incluem fenômenos trombóticos, hemorragia, necrose cutânea , reações hematológicas, renais e hepáticas. O efeito anticoagulante destes compostos pode ser antagonizado através do uso de vitamina K , porém como o antagonismo conferido por este tratamento exige a síntese dos fatores que foram previamente inibidos, situações de emergência exigem reposição dos fatores de coagulação através da reposição de plasma fresco.
Monitorizando a Terapia com Cumarínicos
A intensidade dos efeitos do warfarin na síntese dos fatores de coagulação diferem entre os pacientes , e até mesmo no mesmo indivíduo. Por conta disso uma monitorização eficaz é necessário quando do tratamento com esta droga .. O teste utilizado para monitorização da terapia é o Tempo de Protrombina (TP) , que das seis proteínas vitamina K-dependente testa apenas 3 ( fatores II, VII e X) . Por outro lado o TP também é sensível a alterações no fator V um fator de coagulação independente da vitamina K. Para determinar o TP , um extrato de tecido (tromboplastina) e cálcio são adicionados ao plasma citratado, e o tempo de formação da fibrina é mensurado. Os extratos de tecido utilizados derivam de órgãos e espécies diferentes , o que exigia que uma padronização fosse criada para um acompanhamento correto dos níveis de anticoagulação . E foi com este fim que foi criado a Relação Normalizada Internacional (RNI) , que é obtido através do seguinte cálculo matemático: (TP paciente / TPnormal)ISI . Esta relação leva em conta as diferenças em relação à potência, dos reagentes utilizados.
No início do tratamento o prolongamento do TP ocorre em conseqüência dos baixos níveis do fator VII , que possui menor meia vida . Consequentemente o paciente pode apresentar um TP prolongado apesar de ainda apresentar a via intrínseca e a via comum sem alterações .Isso explica porque deve-se trocar a terapia com heparina para a anticoagulação oral após um período de pelo menos 1 dia após o RNI desejado ter sido obtido . A monitorização da anticoagulação deve ser feita com regularidade mesmo em pacientes bem controlados já que muitas drogas e alguns tipos de alimentos podem aumentar ou diminuir o efeito dos cumarínicos.
Inibidor Específico da Trombina (Hirudina)
A Hirudina é polipeptídeo , de cadeia única , que possui 65 aminoácidos e peso molecular de aproximadamente 7000 daltons . A hirudina ocorre na natureza em sanguessugas, e é obtida através de técnicas com DNA recombinante para a utilização na prática clínica . Diferente da heparina que possui apenas ação in vivo, a hirudina não precisa de co-fatores endógenos para exercer sua ação anticoagulante , não tendo sua eficácia comprometida por deficiência de qualquer uma dessas proteínas .
A hirudina é um inibidor da trombina, a quem ela se liga com grande afinidade. Com esta ligação todas as funções conhecidas da trombina são inibidas
A meia vida da hirudina em indivíduos jovens é de aproximadamente 60 minutos, enquanto sua meia-vida em relação ao prolongamento do TTPa é de cerca de 2 horas. A hirudina recombinante é um alérgeno fraco.
Diferente da heparina não fracionada e da HBPM , a hirudina penetra no trombo e neutraliza a trombina ligada a fibrina. Além disso a Hirudina, mas não a heparina, reduz a deposição plaquetária após lesão vascular. Como a hirudina não é inibida pelas proteínas plasmáticas e pelo endotélio , seu agente anticoagulante é mais previsível . A agregação plaquetária induzida pela trombina também é inibida , mas não a agregação induzida por outras vias.
Apesar destas características potencialmente benéficas da hirudina , ela não possui antídoto , logo não pode ser antagonizada, e como todas as funções da trombina são inibidas, a ligação entre a trombina e a trombomodulina também é inibida, reação esta que é pré-requisito para a ativação da proteína C e S.
Inibidores da Função Plaquetária
Como já foi dito , as plaquetas desempenham um papel muito importante na manutenção da hemostasia . Por conta disso , e pela diversidade dos mecanismos envolvidos na ativação plaquetária (Fig 4), inúmeras abordagens tem sido desenvolvidas para diminuir a atividade plaquetária. Várias novas estratégias têm sido desenvolvidas como a inibição da síntese da tromboxano sintetase, da tromboxano-endoperoxidase, da modulação da adenilado ou guanilato ciclase (análogos da prostaciclina), a interferência com a glicoproteína Ib-IX (anticorpos monoclonais contra GP1b-IX, fragmentos de von Wilebrand recombinante) e o bloqueio específico da proteína IIb-IIIa (peptídeos sintéticos, anticorpos monoclonais . Existem muitas revisões sobre inibidores plaquetários, apenas os mais comuns na prática clínica atual serão abordados aqui .
Fig 4. Mecanismos envolvidos na ativação plaquetária. Abreviações: AC , adenilato cilcase; DAG , diacilglicerol; PLA, fosfolipase A2 ; PLC, fosfolipase C ; AA, ácido aracnóide; CO, ciclooxigenase; IP ,inositol trifosfato ; CM, calmodulina ;PC , fosfatidilcolina.
Aspirina
Muitas vias enzimáticas levam a agregação plaquetária , a aspirina ao inibir irreverssivelmente a cicloxigenase, inibe seletivamente a via de formação do tromboxano, impedindo apenas parcialmente a agregação plaquetária induzida pelo ADP , colágeno e baixos níveis de trombina. Desde seu lançamento no início do século , a aspirina goza de lugar destacado em relação a consumo e popularidade. Seu nome foi cunhado a partir da denominação Spirae , que identifica um gênero botânico onde se encontram várias espécies que contém salicilato ou derivados em estado natural.
A forma não ionizada dos salicilatos é absorvida por difusão através do trato gastrointestinal. Após a ingestão de 500 mg da droga , os níveis plasmáticos obtidos estão em torno de 20-50Mg/ml . Mais de 50% da droga circulante incorpora-se a proteínas , especialmente a albumina. Após a absorção a aspirina é rapidamente hidrolisada em ácido salicílico no fígado. As etapas subsequentes do metabolismo envolvem a conjugação com a glicina e com a ácido glicurônico, formando o ácido saliciúrico e glicuronídeos. Esses metabólicos e a forma livre da aspirina são eliminados principalmente via urinária.
Os efeitos colaterais da aspirina envolvem principalmente o trato gastrointestinal e envolvem : náuseas , dor epigástrica , úlcera péptica e sangramento .
A aspirina não inibe a aderência plaquetária ao subendotélio ou às placas ateroscleróticas , e nem se opõe a liberação dos grânulos plaquetários. Doses de aspirina variando de 1mg/kg a 1300mg dia produzem efeitos similares na inibição da cicloxigenase plaquetária, com doses elevadas sendo necessárias em situações que geram menor biodisponibilidade da droga. As doses mais altas estão associadas a maiores efeitos colaterais. Apesar da meia vida da plaqueta estar entre 7 a 10 dias , o uso diário da aspirina é necessário na maioria das situações pois , a taxa de renovação diária das plaquetas (cerca de 10%) gera um pool de plaquetas não inibidas suficientes para provocar agregação plaquetária com repercussões clínicas importantes. Preparações de aspirina de liberação lenta, especialmente as de liberação entérica , estão associadas a menor taxa de efeitos colaterais .
Há evidências crescentes que a ação antitrombótica da aspirina seja devido não apenas a inibição da cicloxigenase. Estudos sugerem que a aspirina poderia exibir sua atividade através de da acetilação de algumas proteínas ou através do bloqueio da via da lipoxigenase. A demonstração da existência de dois tipos de cicloxigenase (COX-1 e COX-2) , e estudos futuros podem elucidar todo o mecanismo de ação da aspirina.
Ticlopidina
A ticlopidina pode ser considerada um bioprecursor, ela é inativa in vitro , mas possue uma potente ação anti-agregante in vivo. Ela é um antagonista seletivo não competitivo da agregação plaquetária induzida pelo ADP, que atua bloqueando especificamente a ativação da proteína IIb/IIIa. A ligação do fibrinogênio a proteína IIb/IIIa desencadeada pelo ADP é drasticamente inibida .
A ação da ticlopidina aparece lentamente após o início do uso da droga, sedo necessário três a sete dias para se alcançar o efeito máximo. O principal e mais perigoso efeito colateral da ticlopidina é a depressão da medula óssea. Uma monitorização rigorosa é necessária pelo menos nas primeiras 12 semanas de tratamento . Um análogo da ticlopidina , o Clopidogrel foi desenvolvido , e este composto não mostrou-se tóxico para a célula pluripotente da medula óssea.
Apesar de apresentar eficácia semelhante ou até mesmo melhor que a aspirina em algumas situações, o emprego da ticlopidina ainda encontra-se restrito devido aos seus efeitos indesejados e seu alto custo.
Drogas Trombolíticas
Os trombolíticos agem ativando tanto o plasminogênio solúvel quanto o ligado à superfície, para formar a plasmina. A plasmina quando gerada dissolve o trombo digerindo a fibrina. Os trombolíticos podem ser divididos em coágulo-específicos ,quando agem apenas no plasminogênio ligado a superfície , ou coágulo-não específicos , quando estimulam também a ativação do plasminogênio circulante , gerando uma resposta lítica sistêmica (Fig.5).
Estrptoquinase
A estreptoquinase é uma proteína produzida por varias cepas de streptococos hemolíticos . Ela é constituída por uma cadeia polipeptídica única com 414 aminoácidos , com peso molecular de cerca de 50.000 daltons. A estreptoquinase é um trombolítico não coágulo seletivo, que age indiretamente sobre a fibrina através da ativação do plasminogênio. Após sua administração a estreptoquinase forma um complexo com o plasminogênio. Este complexo passa por uma alteração conformacional que expõe o sítio ativo do plasminogênio . Esses sítios ativos catalisam a ativação do plasminogênio em plasmina. O complexo estrptoquinase-plasmina possui os mesmos sítios ativos da plasmina isolada, porém não possui a capacidade de ativar o plasminogênio e não é inibida pela alfa2-antiplasmina.
Muitos indivíduos possuem anticorpos anti estreptoquinase circulantes decorrentes de infecções prévias. Estes indivíduos necessitam de doses de estreptoquinase suficientes para neutralizar estes anticorpos. Após alguns dias da infusão de estreptoquinase os títulos destes anticorpos elevam-se em 50 a 100 vezes em relação aos valores iniciais, permanecendo em altos títulos por um período de 4 a 6 meses . Por conta disso a estreptoquinase só deve ser reutilizada em um mesmo paciente após um período de do 2 anos ou de preferência, nunca mais .
A principal reação adversa da estreptoquinase é a hemorragia , que pode ocorrer em qualquer lugar. O efeito fibrinolítico pode ser inibido utilizando-se inibidores da fibrinólise, como o ácido aminocaproico ou tranexânico. Apesar de ser uma proteína estranha , a estreptoquinase raramente produz broncoespasmo , rash ou reação anafilática.
Fig 5. Mecansmo de ação de vários trombolíticos ativadores do plasminogênio. O ativador do plasminogênio tecidual recombinante (rTPA) e a pró-uroquinase (proUK) agem preferencialmete sobre o plasminogênio ligado à fibrina, enquanto que a uroquinase (UK) ,a estrptoquinase (SK) e a anistreplase (APSAC) ativam tanto o plasminogênio ligado a fibrina quanto o plasminogênio livre.
Complexo Ativador da Estrptoquinase Plasminogênio Anisoilato
O complexo ativador da estreptoquinase anisoilato (anistreplase, APSAC) é um trombolítico não coágulo específico, que foi construído com a ajuda da ação enzimática controlada do complexo plasmina-estreptoquinase com uma proteção química reversível do seu centro catalítico. É uma pró-enzima , após a injeção , a hidrólise leva a desacetilação do complexo, que se torna enzimaticamente ativo. Sua meia vida plasmática é de cerca de 70 minutos , em contraste com a meia vida de 25 minutos do complexo estreptoquinase-plasminogênio. Os pacientes que possuem altos títulos de anti-corpos anti-estreptoquinase também não respondem bem com o uso da anistrplase.
Uroquinase
A uroquinase é uma enzima proteolítica , isolada da urina humana ou de culturas de tecidos de rins humanos. A uroquinase é secretada como uma pró-enzima de cadeia única (scu-PA) , a partir da qual é produzida, por proteólise , o ativador do plasminogênio enzimaticamente ativo (tcu-PA) com duas cadeias, uma com peso molecular de 20.000 e outra de 34.000. A uroquinase é um ativador direto do plasminogênio , não é pirogênica ou antigênica , sendo raras as reações alérgicas. A uroquinase utilizada na clínica foi preparada a partir de culturas de células renais embrionárias , e deve ser submetidas a ensaios biológicos e padronizada. Atualmente dispõe-se também do ativador recombinante do plasminogênio da uroquinase de cadeia única (r-scuPA) , este é convertido em uroquinase quando liga-se à fibrina , sendo portanto um agente trombolítico coágulo seletivo.
Ativador do Plasminogênio Tecidual
O ativador do plasminogênio tecidual (t-PA) natural , é uma proteinase sérica , com peso molecular de 70.000, composto por uma cadeia polipeptídica de 527 aminoácidos. t-PA é convertida pela plasmina em uma forma com cadeia dupla que são mantidas unidas por pontes dissulfeto. O ativador do plasminogênio tecidual utilizado na prática clínica é produzido por técnica de DNA recombinante (altepase) , e consiste principalmente numa forma de cadeia clínica.
A ativação do plasminogênio pelo t-PA é maior na presença de fibrina, o que torna o t-PA um trombolítico seletivo. A fibrina fornece uma superfície que adsorve o t-PA e o plasminogênio , aumentando a concentração do plasminogênio e aumentando a interação entre o t-PA e seu substrato. A alta afinidade do t-PA pelo plasminogênio na presença da fibrina permite ação eficiente no trombo de fibrina enquanto nenhuma ativação eficiente do plasminogênio ocorre no plasma. A plasmina formada na superfície da fibrina tem tanto seus sítios de atividade lítica ocupados como seus sítios de ligação , e por isso é lentamente inativada pela alfa2-antiplasmina. A meia vida da plasmina ligada varia de 10 a 100 segundos , enquanto que a plasmina livre tem meia-vida de cerca de 0,1 segundo.
Reteplase
Reteplase é uma variante do t-PA . O sítio proteolítico ativo e a ação plasminogeniolítica da reteplase não diferem do t-PA na ausência de um estimulador, mas a ação plasminogeniolítica da reteplase na presença de fragmentos de fibrinogênio é 4 vezes menor que a do t-PA , e a ligação da reteplase a fibrina é 5 vezes menor que o t-PA. Essas diferenças podem ser explicadas pela ausência de alguns domínios que a reteplase apresenta. Reteplase e t-PA são inibidos pela PAI-1 em níveis semelhantes.
Análises da farmacocinética da droga mostraram uma maior meia vida da reteplase em relação ao t-PA, em estudos animais a meia vida da reteplase foi de 18,9± 1.5 minutos contra 2,1±0,1 minutos da alteplase.
geovisit();
Monday, November 06, 2006
NOVAS DROGAS ANTICOAGULANTES
NOVEL ANTICOAGULANT DRUGS
Luciana C. O. de Oliveira
1
& Rendrik F. Franco
2
1
Médica Residente da Divisão de Hematologia, HC-FMRP-USP.
2
Professor Livre-Docente de Hematologia e Hemoterapia. Cordenador
do Serviço de Investigação em Hemofilia e Trombofilia, Fundação Hemocentro de Ribeirão Preto. Coordenador do Laboratório de
Hemostasia, Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo
C
ORRESPONDENCIA
: FUNDHERP, Rua Tenente Catão Roxo, 2501 œ 14051-140, Ribeirão Preto, SP. E-mail: rendri@hotmail.com
OLIVEIRA LCO & FRANCO RF. Novas drogas anticoagulantes. Medicina, Ribeirão Preto, 34: 276-281,
jul./dez. 2001.
RESUMO: A presente revisão discute as características e o uso clínico potencial de novos
agentes anticoagulantes, com ênfase para os inibidores dos fatores da coagulação IIa (trombi-
na), IXa, Xa e FVIIa/fator tecidual, e para agentes que potencializam os mecanismos
anticoagulantes e fibrinolíticos.
UNITERMOS: Anticoagulantes. Trombose.
276
Medicina, Ribeirão Preto,
Simpósio:
HEMOSTASIA E TROMBOSE
34: 165,170+jul./dez. 2001
Capítulo VI
1. INTRODUÇÀO
As drogas anticoagulantes atualmente disponí-
veis para tratamento do trombembolismo venoso (TEV)
são, de modo geral, efetivas, mas ainda apresentam
significativas limitações
(1)
. Por exemplo, o uso da he-
parina e dos cumarínicos é associado a dois importan-
tes problemas: janela terapêutica estreita e grande va-
riabilidade na relação dose-resposta. Por essas razões,
o emprego desses agentes pode causar sangramen-
tos, e implica realização periódica de exames labora-
toriais para monitorização de sua eficácia anticoagu-
lante
(1)
. Em adição, os efeitos anticoagulantes impre-
visíveis e erráticos da heparina e dos cumarínicos, res-
pectivamente, representam outras relevantes limita-
ções para seu uso seguro. Pelas razões expostas, hou-
ve, nos últimos anos, interesse crescente no desenvol-
vimento de novas drogas antitrombóticas com efeito
anticoagulante
(2,3,4)
. Em especial, estratégias de inibi-
ção de trombogênese dirigiram-se à inibição da
trombina, à prevenção da sua geração e ao bloqueio
do início da coagulação (Figura I). Nesse contexto, a
inativação da trombina (IIa), fator Xa, fator IXa e do
complexo fator VIIa/fator tecidual foi alvo de diver-
sos estudos
(2,3,4,5)
. Outra estratégia terapêutica sob ava-
liação envolve a atenuação da trombogênese, agindo
na via dos anticoagulantes naturais e na fibrinólise.
No presente texto, revisaremos o uso potencial
de novas drogas anticoagulantes como agentes tera-
pêuticos em doenças trombóticas, As principais ca-
racterísticas desses anticoagulantes encontram-se re-
sumidas na Tabela I. Deve ser ressaltado que a utili-
zação da maior parte desses agentes é ainda experi-
mental, e, de fato, novos dados acerca de sua eficácia
como antitrombóticos serão necessários antes que seu
uso possa ser recomendado na prática clínica.
2. INIBIDORES DA TROMBINA
A trombina pode ser inibida indiretamente por
agentes que ativam inibidores da trombina de ocor-
rência natural (antitrombina ou cofator II da hepari-
na) ou diretamente por drogas que se ligam à trombi-
na e impedem sua ligação com o substrato.
Page 2
277
Novas drogas anticoagulantes
Figura I: Etapas da coagulação e sítios de ação dos novos anticoagulantes.
atualmente, conduzidos para a comparação da hepari-
na de absorção oral com a de baixo peso molecular na
profilaxia do TEV.
O sulfato de dermatan age como anticoagulan-
te, ativando o cofator II da heparina, que é um inibidor
da trombina de ocorrência natural, que se mostrou efe-
tivo na tromboprofilaxia de pacientes com câncer.To-
davia, sua utilização como agente terapêutico é ainda
limitada na prática, em função de sua baixa solubilida-
de e especificidade, o que dificulta sua administração
por via subcutânea.
2.2. Inibidores diretos da trombina
A trombina é composta de 295 aminoácidos
que formam duas cadeias de polipeptídeos, unidas por
uma ponte dissulfeto simples. Existem três domínios
funcionais na molécula de trombina: o sítio catalítico
2.1. Inibidores indiretos da trombina
A heparina não fracionada (HNF) e a heparina
de baixo peso molecular (HBPM) são drogas usadas
na profilaxia e tratamento do TEV e (em associação
com agentes trombolíticos e antiplaquetários) são tam-
bém utilizadas nas síndromes isquêmicas coronarianas
agudas. O uso clínico das heparinas encontra-se dis-
cutido no capítulo sobre tratamento do TEV.
Estudos em desenvolvimento tentam viabilizar
o uso de preparações de HNF e HBPM para adminis-
tração oral. São utilizados aminoácidos sintéticos, como
o N-(8[2-hidroxibenzoil] amino) caprilato de sódio, para
facilitar a absorção intestinal da heparina. Embora a
absorção seja limitada e variável, verificou-se que a
heparina administrada por via oral resulta em prolon-
gamento do TTPA. Estudos clínicos em fase III são,
Page 3
278
LCO Oliveira & RF Franco
ou ativo; o sítio externo de ligação aniônica que possui
o sítio de reconhecimento do fibrinogênio e o terceiro
domínio é o sítio de ligação apolar que está localizado
próximo ao sítio ativo e pode ser importante para a
ligação da fibrina.
Os inibidores diretos da trombina têm vanta-
gens potenciais sobre as heparinas, porque podem ini-
bir a trombina ligada à fibrina, um importante media-
dor do crescimento do trombo. Adicionalmente, esses
inibidores produzem uma resposta anticoagulante mais
previsível que a HNF, pois não se ligam a proteínas
plasmáticas e não são neutralizados pelo fator 4 pla-
quetário, uma proteína que se liga à heparina liberada
durante a ativação plaquetária. As drogas que têm
sido estudadas clinicamente são a hirudina (desirudina),
um análogo semi-sintético da hirudina, conhecido como
bivalirudina, e os inibidores do sítio ativo de baixo peso
molecular, como o argatroban (novastan), efegatran e
inogatran.
A hirudina e bivalirudina são mais específicas para
a trombina que os inibidores de sítio ativo; por serem
bivalentes, ligam-se à trombina no sítio externo (sítio de
reconhecimento do substrato) e no sítio ativo. Em con-
traste, os inibidores de baixo peso molecular se ligam
apenas ao sítio ativo da trombina. Devido ao fato de o
sítio ativo da trombina ser estruturalmente semelhante
ao de outras proteases, esses agentes são menos sele-
tivos para a trombina que os inibidores bivalentes.
2.2.1. Hirudina
A hirudina é um polipeptídeo de 65 aminoáci-
dos, que foi isolado das glândulas salivares do san-
guessuga Hirudo medicinalis, e que pode ser produ-
zido por tecnologia de DNA recombinante. Trata-se
de potente inibidor natural da trombina, formando com
a mesma um complexo cuja dissociação é lenta. O
domínio aminoterminal interage com o sítio ativo da
trombina, enquanto o domínio carboxiterminal se liga
ao sítio externo da enzima. O metabolismo da droga é
predominantemente renal, com pequena parte sendo
metabolizada pelo fígado. A meia-vida, após adminis-
tração venosa, é de 40 minutos, e de aproximadamen-
te 120 minutos após injeção subcutânea. A sua liga-
ção quase irreversível com a trombina pode ser consi-
derada um problema potencial, já que não se conhece
antídoto, caso ocorra sangramento.
Page 4
279
Novas drogas anticoagulantes
Essa droga tem sido usada com sucesso em
pacientes com complicações trombóticas por trombo-
citopenia induzida por heparina (TIH). Pode ainda ser
usada como alternativa à heparina durante bypass
cardiopulmonar em pacientes com TIH. Mostrou-se
que a hirudina pode ser superior à HNF e à HBPM na
tromboprofilaxia, em pacientes submetidos a artroplas-
tia de quadril eletiva. Em pacientes com angina instá-
vel e infarto do miocárdio sem elevação ST, a hirudina
parece ser mais efetiva que a HNF e, embora aumen-
te o risco de sangramento nesses pacientes, não se
observa aumento significante da ocorrência de san-
gramentos graves. Não obstante esses dados promis-
sores, a experiência documentada de uso de hirudina
no tratamento do TEV é ainda limitada, e fatores adi-
cionais referentes a custo e risco hemorrágico repre-
sentam importantes barreiras para a disseminação de
seu uso clínico.
2.2.2. Bivalirudina
A bivalirudina é um inibidor bivalente da trom-
bina, semi-sintético. É composta por um polipeptídeo
de 20 aminoácidos que contém um fragmento inibitó-
rio do sítio ativo da trombina, D-Phe-Pro-Arg-Pro, li-
gado por quatro resíduos de glicina a uma dodecapep-
tídeo análogo à região carboxiterminal da hirudina, que
se liga ao sítio externo da trombina. A bivalirudina di-
fere da hirudina por apresentar inibição transitória do
sítio ativo, pois, após a ligação com a trombina, a liga-
ção Arg-Pro da extensão aminoterminal da bivalirudina
é clivada, converte a bivalirudina em um inibidor da
trombina de baixa afinidade. A curta meia-vida da droga
é uma vantagem sobre a hirudina. Estudos clínicos em
fase III mostraram a segurança do uso da bivalirudina
em relação à HNF em pacientes submetidos à angio-
plastia coronariana. Pequena parte da droga é excre-
tada por via renal, sugerindo que o metabolismo hepá-
tico e em outros sítios contribua para seu clearance.
2.2.3. Argatroban
O argatroban é um derivado do ácido carboxíli-
co e se liga não covalentemente ao sítio ativo da trom-
bina. Constitui alternativa terapêutica efetiva para
pacientes com diagnóstico de TIH e, de fato, seu uso
é aprovado nessa situação. O efegratan e o inogratan
também são potentes inibidores do sítio ativo da trom-
bina in vitro.
2.2.4. H376/95
O H376/95 é uma droga precursora do mela-
grastan, de formulação oral, que possui pequena ativi-
dade intrínseca contra a trombina. É bem absorvida
pelo trato gastrointestinal e se transforma rapidamen-
te em melagastran, um inibidor da trombina dirigido
contra o sítio ativo da trombina. Essa droga possui
efeitos anticoagulantes previsíveis, após administra-
ção oral, e pouca ou nenhuma monitorização labora-
torial parece ser necessária. Estudos clínicos em fase
III, para melhor definição de suas indicações clínicas,
estão sendo realizados.
3. INIBIDORES DO FATOR IXA
As estratégias para inibir o fator IXa da coagu-
lação incluem o uso de fator IXa com o sítio ativo
bloqueado e o uso de anticorpos monoclonais contra o
fator IX/IXa.
3.1. Fator IXa com o sítio ativo bloqueado
Por competição com o fator IXa na incorpora-
ção ao complexo tenase intrínseco, o fator IXa com o
sítio ativo bloqueado inibe a formação de coágulo in
vitro e bloqueia a trombose arterial em modelo cani-
no, sugerindo que esse agente possa ser efetivo como
agente antitrombótico.
3.2. Anticorpos contra o fator IX/Xa
Anticorpos monoclonais contra o fator IX/Xa
bloqueiam também a ativação do fator X pelo fator
IXa, inibindo ainda a ativação do fator IX e bloquean-
do a atividade do fator IXa. Estudos clínicos em fase
I estão sendo realizados para testar a utilidade desses
agentes como antitrombóticos.
4. INIBIDORES DO FATOR XA
Dentre os inibidores do fator Xa, destacam-se
o pentassacarídeo sintético (análogo da seqüência
pentassacarídea da heparina e que age indiretamente
por inativação da antitrombina) e os inibidores diretos,
como os análogos recombinantes dos inibidores natu-
rais e as drogas que agem no sítio ativo do fator. Os
inibidores diretos do fator Xa inativam tanto o fator
Xa livre quanto o ligado à superfície das plaquetas,
diferentemente da HNF e HBPM que agem apenas
sobre o fator livre.
4.1. Pentassacarídeo sintético
O pentassacarídeo sintético é um análogo sin-
tético de uma seqüência da heparina que corresponde
ao sítio de ligação com a antitrombina. Ele aumenta a
taxa de inativação do fator Xa pela antitrombina. Essa
Page 5
280
LCO Oliveira & RF Franco
droga é administrada por via subcutânea e uma vez
ao dia. Estudos clínicos em fase III, comparando essa
droga com a HBPM na prevenção de TEV, estão em
andamento.
4.2. Inibidores naturais
Um peptídeo anticoagulante, designado TAP, a
antistatina e a lefaxina são os inibidores naturais do
fator Xa. Esses agentes ainda não foram testados em
humanos.
O TAP é um polipeptídeo de 60 aminoácidos,
isolado do carrapato Ornithodoros moubata e que
forma um complexo estequiométrico com o fator Xa.
O TAP inicialmente se liga ao fator Xa com baixa
afinidade, em um sítio distinto do sítio catalítico e, pos-
teriormente, interage com alta afinidade com o sítio
ativo, formando um complexo inibidor-enzima estável.
Ainibição do fator Xa pelo TAPé dependente de dose.
Existe a forma recombinante disponível.
A antistasina é um polipeptídeo isolado das
glândulas salivares do sanguessuga Haementeria
officinalis, altamente seletiva para o fator Xa. Tan-
to a forma nativa quanto a recombinante se ligam
fortemente ao fator Xa, constituindo inibidores de
reversão lenta.
A lefaxina é um polipeptídeo de 30kDa, isolado
da saliva do sanguessuga Haementeria depressa, que
apesar de não possuir seu gene codificado parece não
apresentar homologia com os outros inibidores natu-
rais do fator Xa.
4.3. Inibidores sintéticos do fator Xa
DX-9065a, YM-60828, SF 303 e SK 549 são
inibidores reversíveis do fator Xa, não peptídeos, de
baixo peso molecular, que apresentam ação antitrom-
bótica em modelos animais. O uso de alguns desses
inibidores sintéticos em humanos encontra-se sob ava-
liação, mas não há, até o momento, resultados que
autorizem sua utilização na prática clínica.
5. INIBIDORES DA VIA DO FATOR TECI-
DUAL/FATOR VIIA
O bloqueio dessa via tem sido objeto de estudo,
dada sua importância no início da coagulação.O inibi-
dor da via do fator tecidual (tissue factor pathway
inhibitor, TFPI) e o peptídeo anticoagulante deri-
vado de nematódeo (NAPc2) são os agentes com os
quais maior experiência clínica foi acumulada até o
momento.
5.1. TFPI
O TFPI é um inibidor do fator VIIa, dependen-
te do fator Xa, que está presente em pequena quanti-
dade no sangue, na forma livre ou estocado em pla-
quetas. A maior parte desse inibidor está ligada a
lipoproteínas ou ao endotélio. A administração de HNF
ou HBPM resulta em liberação de TFPI endotelial,
provavelmente por esses agentes desfazerem a liga-
ção do TFPI com as glicosaminoglicanas do endotélio.
O TFPI inibe diretamente o fator Xa e isso serve como
cofator para inibição do complexo fator tecidual/fator
VIIa. Esse inibidor, quando administrado por via endo-
venosa, tem a meia-vida curta, sendo clivado rapida-
mente por proteases. Em coelhos e babuínos, o TFPI
atenua a coagulopatia e aumenta a sobrevida em mo-
delos de sépsis. Existem estudos em fase III para ava-
liação desse agente em pacientes com sépsis.
5.2. NAPc2
O NAPc2 é uma pequena proteína isolada de
Ancylostoma caninum, que se liga ao sítio não catalí-
tico do fator X e fator Xa e inibe o fator VII do complexo
VIIa/FT. Por se ligar ao fator X , sua meia-vida é de
quase 50 horas após a injeção subcutânea. Estudos
clínicos em fase II,utilizando esse agente na preven-
ção de TEV, em pacientes submetidos a artroplas-tia
eletiva de joelho, encontram-se em andamento.
6. POTENCIAÇÀO DA ATIVIDADE ANTI-
COAGULANTE ENDÌGENA
As estratégias são focadas na via anticoagu-
lante da proteína C, com a administração de (a) proteí-
na C ou proteína C ativada, (b) trombomodulina solú-
vel, (c) derivados da trombina, que ativam preferenci-
almente a proteína C, (d) pequenas moléculas que in-
duzem mudança de conformação na trombina, levan-
do à sua ligação com a trombomodulina.
6.1. Proteína C
A proteína C derivada do plasma e a recombi-
nante representam objeto de estudos em andamento,
em pacientes com coagulopatia induzida pela sépsis.
De fato, um estudo recente demonstrou a eficácia da
administração de concentrado de PC recombinante,
controlando a coagulopatia e reduzindo a mortalidade
associada à sépsis.
6.2. Trombomodulina solúvel
A trombomodulina solúvel forma um complexo
Page 6
281
Novas drogas anticoagulantes
com a trombina que induz uma mudança conforma-
cional no sítio ativo da enzima que abole a atividade
procoagulante da trombina e a converte num potente
indutor da proteína C ativada. Esse agente é um im-
portante antitrombótico em vários modelos animais.
Não há, todavia, até o momento, experiência acumu-
lada que permita recomendar seu uso como agente
antitrombótico em humanos.
6.3. Variantes da trombina
Esses agentes ativam a proteína C, mas exi-
bem mínima atividade protrombótica. Foram descri-
tas as variantes de trombina com a substituição do
resíduo Glu na posição 229 por Ala ou Lys. Dados
acerca da utilidade clínica desses agentes ainda não
se encontram disponíveis.
7. MODULAÇÀO DA ATIVIDADE FIBRINO-
LÈTICA ENDÌGENA
Com o objetivo de aumentar a atividade fibri-
nolítica endógena, as seguintes estratégias encontram-
se em estudo: o bloqueio do inibidor do ativador do
plasminogênio tipo 1 (PAI-1), a inibição das enzimas
carboxilases-like e a inibição do fator XIII ativado.
7.1. Inibidores do PAI-1
Como o PAI-1 é o principal inibidor fisiológico
do ativador de plasminogênio do tipo tecidual e urinário
(t-PA e u-PA, respectivamente), sua inibição resulta
no aumento da atividade fibrinolítica endógena. Os
peptídeos com ação de bloqueio do PAI-1 ainda não
foram testados in vivo.
7.2. Inibidores da procarboxipeptidase B
A procarboxipeptidase B ou inibidor da fibrinó-
lise ativado pela trombina (TAFI) é uma enzima
carboxipeptidase-like que é ativada pelo complexo
trombina-trombomodulina. Assim, inibidores da pro-
carboxipeptidase B devem aumentar a atividade fibri-
nolítica, o que de fato foi observado em estudos com
coelhos e cães. Algumas variantes da trombina têm
capacidade diminuída de ativar a procarboxipeptidase
B, mas mantêm sua propriedade de ativar a proteína
C.
7.3. Inibidores do fator XIIIa
O fator XIIIa é uma transglutaminase ativada
pela trombina. É responsável pela estabilização do
coágulo de fibrina por promover a ligação das cadeias
e do fibrinogênio, formando os -polímeros e os
-dímeros. Essa polimerização torna o coágulo refra-
tário à degradação pela plasmina. Dessa maneira, a
inibição do fator XIII potencialmente aumenta a sus-
ceptibilidade de lise do trombo. Um peptídeo inibidor
do fator XIIIa (tridegina) foi recentemente descrito, e
trata-se de potencial agente antitrombótico a ser ex-
plorado em futuros estudos.
4 - WEITZ JI & HIRSH J. New antithrombotic drugs. In: COLMAN
RW; HIRSH J; MARDER VJ; CLOWES AW & GEORGE JN, eds.
Hemostasis and thrombosis. basic principles and clini-
cal practice. 4
th.
ed. Lippincott Williams & Wilkins, Philadel-
phia, p.1529-1544, 2001.
5 - FRANCO RF. Fisiologia da coagulação do sangue e fibrinóli-
se. In: ZAGO MA; FALCÀO RP & PASQUINI R,eds
Hematologia: fundamentos e prática. Editora Atheneu,
São Paulo, p.739-748, 2001.
Recebido para publicação em 28/06/2001
Aprovado para publicação em 24/08/2001
REFERÂNCIAS BIBLIOGRÊFICAS
1 - MAFFEI FHA; ROLLO HÊ & LASTÌRIA S. Trombose venosa
profunda dos membros inferiores: tratamento clínico. In:
MAFFEI FHA; LASTÌRIA S; YOSHIDA WB & ROLLO HA Do-
enças vasculares periféricas. 3
ª
ed. Editora Medsi, Rio de
Janeiro, p.1407-1426, 2001.
2 - ANSELL JE; WEITZ JI & COMEROTAAJ. Advances in therapy
and the management of antithrombotic drugs for venous
thromboembolism. In: AMERICAN SOCIETYOF HEMATOLOGY.
Education Program Book. San Francisco, p.266-284, 2000.
3 - HIRSH J & WEITZ JI. New antithrombotic agents. Lancet.
353: 1431-1436, 1999.
OLIVEIRALCO & FRANCO RF. Novel anticoagulant drugs. Medicina, Ribeirão Preto, 34: 276-281, july/dec. 2001.
ABSTRACTS: The present review focuses on the characteristics and potential clinical use of
new anticoagulant drugs, with emphasis on inhibitors of coagulation factors IIa (thrombin), IXa, Xa
and VIIa/tissue factor, and on enhancers of anticoagulant and fibrinolytic activities.
UNITERMS: Anticoagulants. Thrombosis.
